Божествена комедия на Данте Алигиери Анализ на Божествената комедия на Данте Алигиери
Композиционната структура на поемата на Данте "Божествена комедия" "Божествена комедия" на Данте е написана в началото на 14 век. тя...
Има няколко метода за определяне на коефициентите в уравненията на редокс реакциите. Използваме метода на електронния баланс, при който съставянето на пълното уравнение на OVR се извършва в следната последователност:
1. Начертайте диаграма на реакцията, като посочите веществата, които са реагирали, и веществата, получени в резултат на реакцията, например:
2. Определете степента на окисление на атомите и напишете нейния знак и стойност над символите на елементите, като отбележите елементите, чието състояние на окисление се е променило:
3. Запишете електронните уравнения за реакциите на окисление и редукция, определете броя на електроните, отдадени от редуктора и приети от окислителя, и след това ги изравнете, като умножите по подходящите коефициенти:
4. Получените коефициенти, съответстващи на електронния баланс, се прехвърлят към основното уравнение:
5. Изравнете броя на атомите и йоните, които не променят степента на окисление (в последователност: метали, неметали, водород):
6.Проверете правилността на избора на коефициенти въз основа на броя на кислородните атоми от лявата и дясната страна на уравнението на реакцията - те трябва да са равни (в това уравнение 24 = 18 + 2 + 4, 24 = 24).
Нека да разгледаме по-сложен пример:
Нека определим степени на окисление на атомите в молекулите:
Нека съставим електронни уравнения за реакциите на окисление и редукция и изравним броя на отдадените и приетите електрони:
Нека прехвърлим коефициентите към основното уравнение:
Нека изравним броя на атомите, които не променят степента на окисление:
Като преброим броя на кислородните атоми от дясната и лявата страна на уравнението, ще се уверим, че коефициентите са избрани правилно.
Редокс свойствата на елементите зависят от структурата на електронната обвивка на атомите и се определят от тяхното положение в периодичната таблица на Менделеев.
Металите, които имат 1-3 електрона на външно енергийно ниво, лесно ги предават и проявяват само редуциращи свойства. Неметалите (елементи от групи IV-VII) могат както да отдават, така и да приемат електрони, така че могат да проявяват както редуциращи, така и окислителни свойства. В периоди с увеличаване на атомния номер на даден елемент редукционните свойства на простите вещества отслабват и окислителните свойства се увеличават. В групи с нарастващ сериен номер, редукционните свойства се увеличават, а окислителните свойства отслабват. по този начин от простите вещества най-добрите редуциращи агенти са алкалните метали, алуминият, водородът, въглеродът; най-добрите окислители са халогените и кислорода.
Редокс свойствата на сложните вещества зависят от степента на окисление на атомите, които ги изграждат. Веществата, съдържащи атоми с най-ниска степен на окисление, проявяват редуциращи свойства. Най-важните редуциращи агенти са въглеродният окис  , сероводород
, сероводород  , железен (II) сулфат
, железен (II) сулфат  .Веществата, съдържащи атоми с най-висока степен на окисление, проявяват окислителни свойства. Най-важните окислители са калиевият перманганат
.Веществата, съдържащи атоми с най-висока степен на окисление, проявяват окислителни свойства. Най-важните окислители са калиевият перманганат  , калиев дихромат
, калиев дихромат  , водороден прекис
, водороден прекис  , азотна киселина
, азотна киселина  , концентрирана сярна киселина
, концентрирана сярна киселина  .
.
Веществата, съдържащи атоми с междинни степени на окисление, могат да се държат като окислители или редукторив зависимост от свойствата на веществата, с които взаимодействат, и условията на реакцията. Така че в реакция с  сярната киселина проявява редуциращи свойства:
сярната киселина проявява редуциращи свойства:
и когато взаимодейства със сероводород, той е окислител:

В допълнение, за такива вещества са възможни реакции на самоокисление-самонамаляване, протичащи с едновременно повишаване и намаляване на степента на окисление на атомите на един и същи елемент, например:
Силата на много окислители и редуциращи агенти зависи от pH на средата. например, 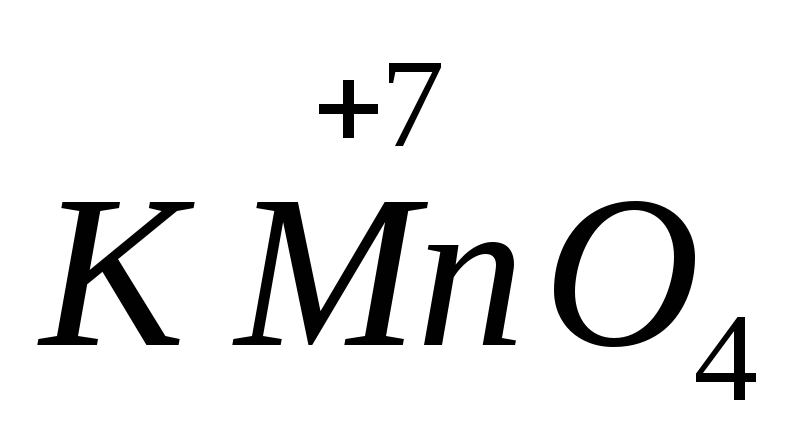 в алкална среда се редуцира до
в алкална среда се редуцира до  , в неутрално към
, в неутрално към  , при наличие на сярна киселина - до
, при наличие на сярна киселина - до  .
.
Уравнението на реакцията в химията е запис на химичен процес с помощта на химични формули и математически символи.
Тази нотация е диаграма на химическа реакция. Когато се появи знакът "=", това се нарича "уравнение". Нека се опитаме да го разрешим.
В калция има един атом, тъй като коефициентът не си струва. Индексът също не е написан тук, което означава единица. От дясната страна на уравнението Ca също е единица. Не е нужно да работим върху калций.
Нека разгледаме следващия елемент – кислорода. Индекс 2 показва, че има 2 кислородни йона. От дясната страна няма индекси, тоест една частица кислород, а отляво има 2 частици. какво правим Не могат да се правят допълнителни индекси или корекции на химичната формула, тъй като е написана правилно.
Коефициентите са това, което е написано преди най-малката част. Те имат право на промяна. За удобство не пренаписваме самата формула. От дясната страна умножаваме едно по 2, за да получим 2 кислородни йона там.

След като зададохме коефициента, получихме 2 калциеви атома. Има само един от лявата страна. Това означава, че сега трябва да поставим 2 пред калций.

Сега нека проверим резултата. Ако броят на атомите на даден елемент е еднакъв от двете страни, тогава можем да поставим знака „равно“.

Друг ясен пример: има два водорода отляво и след стрелката също имаме два водорода.


Умножихме цялата формула по 2 и сега количеството водород се промени. Умножаваме индекса по коефициента и получаваме 4. А от лявата страна остават два водородни атома. И за да получим 4, трябва да умножим водорода по две.

Това е така, когато елементът в едната и другата формула е от една и съща страна, до стрелката.

Един серен йон отляво и един йон отдясно. Две частици кислород плюс още две частици кислород. Това означава, че има 4 кислорода от лявата страна. Вдясно има 3 кислорода. Тоест от едната страна има четен брой атоми, а от другата нечетен брой. Ако умножим нечетното число по два пъти, получаваме четно число. Първо го довеждаме до равна стойност. За да направите това, умножете цялата формула след стрелката по две. След умножение получаваме шест кислородни йона, а също и 2 серни атома. Отляво имаме една микрочастица сяра. Сега нека го изравним. Поставяме уравненията отляво преди сиво 2.

Наречен.
Този пример е по-сложен, защото има повече елементи на материята.

Това се нарича реакция на неутрализация. Какво първо трябва да се изравни тук:
Изводът, който се налага, е, че трябва да умножите цялата формула по две.

Сега да видим колко сяра има. По една от лявата и дясната страна. Да обърнем внимание на кислорода. От лявата страна имаме 6 кислородни атома. От друга страна - 5. По-малко отдясно, повече отляво. Нечетно число трябва да се доведе до четно число. За целта умножаваме формулата на водата по 2, тоест от един кислороден атом правим 2.
Вече има 6 кислородни атома от дясната страна. От лявата страна също има 6 атома. Да проверим водорода. Два водородни атома и още 2 водородни атома. Ще има четири водородни атома от лявата страна. А от другата страна също има четири водородни атома. Всички елементи са равни. Поставяме знака за равенство.

Следващ пример.

Тук примерът е интересен, защото се появяват скоби. Казват, че ако даден фактор е зад скобите, тогава всеки елемент в скобите се умножава по него. Трябва да започнете с азот, тъй като има по-малко от кислорода и водорода. Отляво има един азот, а отдясно, като се вземат предвид скобите, има два.

Има два водородни атома отдясно, но са необходими четири. Излизаме от това, като просто умножим водата по две, което води до четири водорода. Страхотно, водородът изравни. Има останал кислород. Преди реакцията има 8 атома, след това - също 8.
Страхотно, всички елементи са равни, можем да зададем „равни“.

Последен пример.

Следващият е барият. Той е изравнен, не е нужно да го докосвате. Преди реакцията има два хлора, след нея има само един. Какво трябва да се направи? Поставете 2 пред хлора след реакцията.

Сега, поради коефициента, който току-що беше зададен, след реакцията получихме два натрия, а преди реакцията също получихме два. Супер, всичко друго е изравнено.

Можете също така да изравните реакциите, като използвате метода на електронния баланс. Този метод има редица правила, по които може да се приложи. Следващата стъпка е да се подредят степени на окисление на всички елементи във всяко вещество, за да се разбере къде е настъпило окисление и къде е настъпило редукция.
Учителят, като основен герой в организирането на познавателната дейност на учениците, непрекъснато търси начини за подобряване на ефективността на обучението. Организирането на ефективно обучение е възможно само с познаване и умело използване на различни форми на педагогическия процес.
1. Съвременният човек трябва да притежава не само сбор от знания и умения, но и способността да възприема света като единно, сложно, непрекъснато развиващо се цяло.
Статия по химия: „Подреждане на коефициентите в химичните уравнения“
Съставител: учител по химия
ГБОУ средно училище № 626
Казутина О.П.
Москва 2012 г
„Подреждане на коефициентите в химичните уравнения“
Учителят, като основен герой в организирането на познавателната дейност на учениците, непрекъснато търси начини за подобряване на ефективността на обучението. Организирането на ефективно обучение е възможно само с познаване и умело използване на различни форми на педагогическия процес.
1. Съвременният човек трябва да притежава не само сбор от знания и умения, но и способността да възприема света като единно, сложно, непрекъснато развиващо се цяло.
Алгоритъм за подготовка за урок
избор на тема, определяне на цели;
избор на съдържание;
идентифициране на средства и начини за развитие на положително мотивационно отношение на учениците към работата в класната стая;
спецификация на оборудване на урока с необходимия нагледен и дидактически материал;
разработване на план на урока
Пример за урок по химия „Подреждане на коефициентите в химическо уравнение“ за учители
цел: отговорете на въпроса: "защо трябва да поставите коефициенти в химическо уравнение?"
Задачи:
Проблемът с необходимостта от присвояване на коефициенти
Алгоритъм за задаване на коефициенти
Доказателство за значението на подреждането на коефициентите
Напредък на урока:
Съвременният студент, ако учи, се отнася с прагматизъм към знанията, които получава и обработва. Следователно предоставеният материал трябва да се побере в главата ви логично и стегнато.
За да постигне това, учителят винаги трябва да обръща внимание
За какво едно или друго действие трябва да се научи в клас. Тоест учителят трябва да обясни. И тогава, по добър начин, изчакайте правилните въпроси по новата тема.Закон за запазване на масата на веществата
Известният английски химик Р. Бойл, калцинирайки различни метали в отворена реторта и ги претегляйки преди и след нагряване, откри, че масата на металите става по-голяма. Въз основа на тези експерименти той не отчита ролята на въздуха и прави неправилния извод, че масата на веществата се променя в резултат на химични реакции. Р. Бойл твърди, че има някакъв вид „огнена материя“, която, когато металът се нагрява, се комбинира с метала, увеличавайки неговата маса.
Mg + O 2 MgO
24 гр. 40 гр
М. В. Ломоносов, за разлика от Р. Бойл, калцинира метали не на открито, а в запечатани реторти и ги претегля преди и след калциниране. Той доказа, че масата на веществата преди и след реакцията остава непроменена и че по време на калцинирането към метала се добавя част от въздуха. (Кислородът все още не е бил открит по това време.) Той формулира резултатите от тези експерименти под формата на закон: „Всички промени, които се случват в природата, са такива състояния, че всичко, което е взето от едно тяло, се добавя към друго.“ В момента този закон е формулиран, както следва:
Масата на веществата, влезли в химична реакция, е равна на масата на образуваните вещества
Mg + O 2 MgO
24 g 32 g 40 g
Въпрос: законът не е спазен (тъй като масите на първоначалното и крайното вещество не са равни).
Решението на този проблем е подреждането на коефициентите (цели числа, показващи броя на молекулите):
2Mg + O 2 2MgO
48 g 32 g 80 g – масите преди и след са равни поради факта, че броят на атомите на елементите също е равен преди и след реакцията.
По този начин, след като сте доказали на учениците необходимостта от изравняване на масовите коефициенти, можете дори да се справите без някои от предишните теми: съставяне на формули за вещества по валентност, изчисляване на маса, количество вещество ... Също така история за факта, че законът на запазването на масата на материята е „преоткрит” 20 години по-късно от А. Лавоазие, като го е изяснил от една страна, но напълно без да обръща внимание на М.В. Ломоносов с етични въпроси може да бъде оставен за самостоятелно проучване под формата на доклад, например.
И така, за успешно изпълнение на задачи от този вид е необходимо да се разбере условието: броят на атомите преди реакцията db е равен на броя на атомите след реакцията: нека решим заедно:
H 2 S + 3O 2 SO 2 + 2H 2 O (удвояваме кислорода отдясно. Броим ги отляво)
CH 4 + 2O 2 CO 2 + 2H 2 O
Поставихме коефициентите в уравненията на горенето на два газа
ДИАПАЗОН ОТ КОЕФИЦИЕНТИ
Броят на атомите на един елемент от лявата страна на уравнението трябва да бъде равен на броя на атомите на този елемент от дясната страна на уравнението.
Задача 1 (за групи).
Определете броя на атомите на всеки химичен елемент, участващ в реакцията.1. Изчислете броя на атомите:
а) водород: 8NH3, NaOH, 6NaOH, 2NaOH, H3PO4, 2H2SO4, 3H2S04, 8H2SO4;
6)
кислород: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.2. Изчислете броя на атомите: а)
водород:1) NaOH + HCl 2) CH4+H20 3) 2Na+H2
б) кислород:
1) 2СО + 02 2) С02 + 2Н.О. 3) 4NO2 + 2H2O + O2
Алгоритъм за подреждане на коефициенти в уравнения на химични реакции
А1 + О2→ А12О3А1-1 атом А1-2
О-2 атом О-3
2. Измежду елементи с различен брой атоми в лявата и дясната част на диаграмата изберете този, чийто брой атоми е по-голям
O-2 атоми вляво
O-3 атоми вдясно
3. Намерете най-малкото общо кратно (LCM) на броя на атомите на този елемент от лявата страна на уравнението и броя на атомите на този елемент от дясната страна на уравнението
LCM = 6
4. Разделете LCM на броя на атомите на този елемент от лявата страна на уравнението, получете коефициента за лявата страна на уравнението
6:2 = 3
Al + ZO
2 → Ал 2 ЗА 35. Разделете LCM на броя на атомите на този елемент от дясната страна на уравнението, получете коефициента за дясната страна на уравнението
6:3 = 2
А1+ О
2 →2A1 2 O36. Ако зададеният коефициент е променил броя на атомите на друг елемент, повторете стъпки 3, 4, 5 отново.
А1 + ЗО
2 → →2А1 2 ЗА 3А1 -1 атом А1 - 4
LCM = 4
4:1=4 4:4=1
4А1 + ЗО
2 → →2A1 2 ЗА 3.
Първичен тест за придобиване на знания (8-10 мин .).Има два кислородни атома от лявата страна на диаграмата и един от дясната. Броят на атомите трябва да бъде изравнен с помощта на коефициенти.
1) 2Mg+O
2 →2MgO2) СаСО
3 + 2HCl→CaCl2 + Н2 O + CO2Задача 2
Поставете коефициентите в уравненията на химичните реакции (имайте предвид, че коефициентът променя броя на атомите само на един елемент):1. Fe
2 О 3 + А л → А л 2 ЗА 3 + Fe; Mg+N 2 → Mg 3 Н 2 ;2. Al + S
→ Ал 2 С 3 ; А1+ СЪС → Ал 4 В 3 ;3. Al + Cr
2 О 3 → Cr+Al 2 О 3 ; Ca+P → ок 3 П 2 ;4. C +
з 2 → CH 4 ; ок + C → SaS 2 ;5. Fe + O
2 → Fe 3 О 4 ; Si + Mg → Mg 2 Si;6/.Na+S
→ Na 2 S; CaO+ СЪС → CaC 2 + CO;7.Ca+N
2 → В а 3 Н 2 ; Si+Cl 2 → SiCl 4 ;8. Ag+S
→ Ag 2 S; Н 2 + СЪС л 2 → НС л;9.N
2 +О 2 → НЕ; CO 2 + СЪС → CO ;10. ЗДРАВЕЙ →
Н 2 → + 1 2 ; Mg+ НС л → MgCl 2 + Н 2 ;11.
FeS+ НС 1 → FeCl 2 +H 2 S; Zn+HCl → ZnCl 2 +H 2 ;12. Бр
2 +КИ → KBr+I 2 ; Si+HF (r) → SiF 4 +H 2 ;1./ HCl+Na
2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+ SO 2 ;14. Кл
2 + KBr → KCl + Br 2 ; SiO 2 + СЪС → Si + CO;15. SiO
2 + СЪС → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO16
.3. Какво означава знакът "+" в уравнение?
4. Защо в химичните уравнения се поставят коефициенти?
Инструкции
Преди да започнете самата задача, трябва да разберете, че числото, което се поставя пред химичен елемент или цялата формула, е коефициент. И цифрата струва (и малко) индекса. Освен това, че:
Коефициентът се прилага за всички химични символи, които се появяват след него във формулата
Коефициентът се умножава по индекса (не се събира!)
Броят на атомите на всеки елемент от веществата, влизащи в реакцията, трябва да съвпада с броя на атомите на тези елементи, включени в продуктите на реакцията.
Например изписването на формулата 2H2SO4 означава 4 H (водород) атома, 2 S (сяра) атома и 8 O (кислород) атома.
1. Пример № 1. Разгледайте изгарянето на етилен.
Когато органичната материя гори, тя произвежда въглероден оксид (IV) (въглероден диоксид) и вода. Нека опитаме коефициентите последователно.
C2H4 + O2 => CO2+ H2O
Да започнем да анализираме. В реакцията са влезли 2 атома C (въглерод), но се е получил само 1 атом, което означава, че поставяме 2 пред CO2. Сега броят им е същият.
C2H4 + O2 => 2CO2+ H2O
Сега нека да разгледаме Н (водород). В реакцията влязоха 4 водородни атома, но резултатът беше само 2 атома, следователно поставихме 2 пред H2O (вода) - сега също получаваме 4
C2H4 + O2 => 2CO2+ 2H2O
Преброяваме всички атоми О (кислород), образувани в резултат на реакцията (т.е. след равенство). 4 атома в 2CO2 и 2 атома в 2H2O - общо 6 атома. А преди реакцията има само 2 атома, което означава, че поставяме 3 пред кислородната молекула O2, което означава, че има и 6 от тях.
C2H4 + 3O2 => 2CO2+ 2H2O
Така резултатът е еднакъв брой атоми на всеки елемент преди и след знака за равенство.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Разгледайте реакцията на алуминий с разредена сярна киселина.
Al + H2SO4 => Al2 (SO4) 3 + H2
Разглеждаме S атомите, които са част от Al2 (SO4) 3 - има 3 от тях, но в H2SO4 (сярна киселина) има само 1, следователно, ние също поставяме 3 пред сярна киселина.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Но сега има 6 H (водород) атома преди реакцията и само 2 след реакцията, което означава, че също поставяме 3 пред молекулата H2 (водород), така че общо получаваме 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Накрая разглеждаме. Тъй като има само 2 алуминиеви атома в Al2 (SO4) 3 (алуминиев сулфат), поставяме 2 пред Al (алуминий) преди реакцията.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Сега броят на всички атоми преди и след реакцията е еднакъв. Оказа се, че подреждането на коефициенти в химичните уравнения не е толкова трудно. Просто практикувайте и всичко ще се получи.
Полезни съвети
Не забравяйте да имате предвид, че коефициентът се умножава по индекса, а не се добавя.
източници:
За много ученици напишете уравнения на химични реакции и ги поставете правилно коефициентиникак лесна задача. Освен това по някаква причина основната трудност за тях е именно втората му част. Изглежда, че няма нищо сложно в това, но понякога учениците се отказват, изпадайки в пълно объркване. Но просто трябва да запомните няколко прости правила и задачата вече няма да създава трудности.
Инструкции
Коефициент, тоест числото пред формулата на химическа молекула, към всички символи и се умножава по всеки символ! Това е умножаване, а не събиране! Може да изглежда невероятно, но някои ученици добавят две числа, вместо да ги умножат.
Броят на атомите на всеки елемент от изходните вещества (т.е. разположен от лявата страна на уравнението) трябва да съвпада с броя на атомите на всеки елемент от реакционните продукти (съответно разположен от дясната му страна).