Dante Alighieri dieviškoji komedija Dante Alighieri dieviškoji komedija analizė
Dantės poemos „Dieviškoji komedija“ kompozicinė struktūra Dantės „Dieviškoji komedija“ parašyta XIV amžiaus pradžioje. Ji...
Yra keletas redokso reakcijų lygčių koeficientų nustatymo metodų. Mes naudojame elektroninio balanso metodą, kuriame visa OVR lygtis sudaroma tokia seka:
1. Nubraižykite reakcijos diagramą, nurodydami sureaguojusias medžiagas ir po reakcijos susidariusias medžiagas, pvz.:
2. Nustatykite atomų oksidacijos būseną ir virš elementų simbolių parašykite jos ženklą bei reikšmę, pažymėdami elementus, kurių oksidacijos būsena pasikeitė:
3. Užrašykite oksidacijos ir redukcijos reakcijų elektronines lygtis, nustatykite redukuojančio agento atiduotų ir oksiduojančios medžiagos priimtų elektronų skaičių ir išlyginkite jas padaugindami iš atitinkamų koeficientų:
4. Gauti elektroninį balansą atitinkantys koeficientai perkeliami į pagrindinę lygtį:
5. Išlyginkite oksidacijos būsenos nekeičiančių atomų ir jonų skaičių (eilėje: metalai, nemetalai, vandenilis):
6. Patikrinkite koeficientų parinkimo teisingumą pagal deguonies atomų skaičių kairėje ir dešinėje reakcijos lygties pusėse – jie turėtų būti lygūs (šioje lygtyje 24 = 18 + 2 + 4, 24 = 24).
Pažvelkime į sudėtingesnį pavyzdį:
Nustatykime atomų oksidacijos būsenas molekulėse:
Sukurkime elektronines oksidacijos ir redukcijos reakcijų lygtis ir išlyginkime duotų ir priimtų elektronų skaičių:
Perkelkime koeficientus į pagrindinę lygtį:
Išlyginkime atomų, kurie nekeičia oksidacijos būsenos, skaičių:
Suskaičiavę deguonies atomų skaičių dešinėje ir kairėje lygties pusėse, įsitikinsime, kad koeficientai parinkti teisingai.
Elementų redoksinės savybės priklauso nuo atomų elektroninio apvalkalo struktūros ir yra nulemtos jų padėties Mendelejevo periodinėje lentelėje.
Metalai, turintys 1-3 elektronus išoriniame energijos lygyje, lengvai jų atsisako ir pasižymi tik redukuojančiomis savybėmis. Nemetalai (IV-VII grupių elementai) gali ir atiduoti, ir priimti elektronus, todėl gali pasižymėti ir redukuojamomis, ir oksiduojančiomis savybėmis. Laikotarpiais, kai padidėja elemento atominis skaičius, paprastų medžiagų redukuojančios savybės susilpnėja, o oksidacinės savybės didėja. Grupėse, kurių eilės skaičius didėja, redukuojančios savybės didėja, o oksidacinės savybės susilpnėja. Taigi, iš paprastų medžiagų geriausi reduktoriai yra šarminiai metalai, aliuminis, vandenilis, anglis; geriausi oksidatoriai yra halogenai ir deguonis.
Sudėtingų medžiagų redoksinės savybės priklauso nuo jas sudarančių atomų oksidacijos laipsnio. Medžiagos, turinčios mažiausio oksidacijos laipsnio atomų, turi redukuojančių savybių. Svarbiausios reduktorius yra anglies monoksidas  , vandenilio sulfidas
, vandenilio sulfidas  , geležies (II) sulfatas
, geležies (II) sulfatas  .Medžiagos, turinčios didžiausią oksidacijos laipsnį turinčių atomų, pasižymi oksidacinėmis savybėmis. Svarbiausios oksiduojančios medžiagos yra kalio permanganatas
.Medžiagos, turinčios didžiausią oksidacijos laipsnį turinčių atomų, pasižymi oksidacinėmis savybėmis. Svarbiausios oksiduojančios medžiagos yra kalio permanganatas  , kalio dichromatas
, kalio dichromatas  , vandenilio peroksidas
, vandenilio peroksidas  , azoto rūgštis
, azoto rūgštis  , koncentruota sieros rūgštis
, koncentruota sieros rūgštis  .
.
Medžiagos, turinčios atomų su vidutine oksidacijos būsena, gali veikti kaip oksiduojančios arba redukuojančios medžiagos priklausomai nuo medžiagų, su kuriomis jos sąveikauja, savybių ir reakcijos sąlygų. Taigi reaguojant su  sieros rūgštis pasižymi redukuojančiomis savybėmis:
sieros rūgštis pasižymi redukuojančiomis savybėmis:
ir kai sąveikauja su vandenilio sulfidu, jis yra oksidatorius:

Be to, tokioms medžiagoms galimos savaiminio oksidacijos-saviredukcijos reakcijos, kurios vyksta tuo pačiu metu didėjant ir mažėjant to paties elemento atomų oksidacijos būsenai, pavyzdžiui:
Daugelio oksiduojančių ir redukuojančių medžiagų stiprumas priklauso nuo terpės pH. Pavyzdžiui, 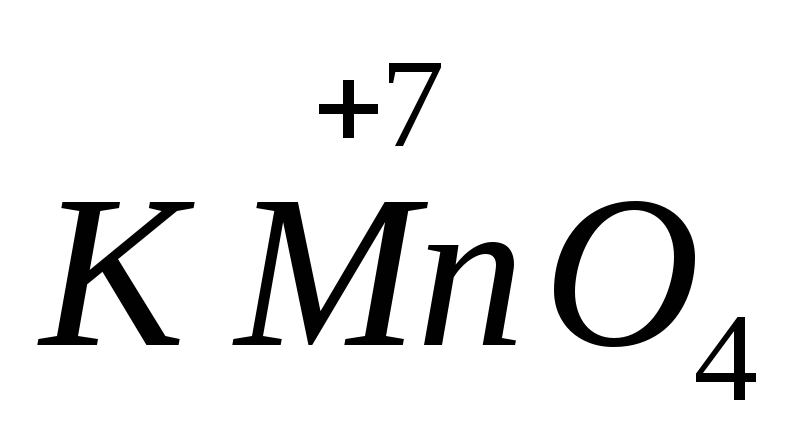 šarminėje aplinkoje sumažėja iki
šarminėje aplinkoje sumažėja iki  , neutralioje į
, neutralioje į  , esant sieros rūgščiai – iki
, esant sieros rūgščiai – iki  .
.
Reakcijų lygtis chemijoje yra cheminio proceso įrašymas naudojant chemines formules ir matematinius simbolius.
Šis žymėjimas yra cheminės reakcijos diagrama. Kai pasirodo „=“ ženklas, tai vadinama „lygtimi“. Pabandykime tai išspręsti.
Kalcio atomas yra vienas, nes koeficientas nėra vertas. Rodyklė čia taip pat neparašyta, o tai reiškia vieną. Dešinėje lygties pusėje Ca taip pat yra vienas. Mums nereikia dirbti su kalciu.
Pažvelkime į kitą elementą – deguonį. 2 indeksas rodo, kad yra 2 deguonies jonai. Dešinėje pusėje nėra indeksų, tai yra viena deguonies dalelė, o kairėje yra 2 dalelės. Ką mes darome? Cheminėje formulėje negalima daryti jokių papildomų indeksų ar taisyti, nes ji parašyta teisingai.
Koeficientai yra tai, kas parašyta prieš mažiausią dalį. Jie turi teisę keistis. Patogumo dėlei pačios formulės neperrašome. Dešinėje pusėje padauginame vieną iš 2, kad gautume 2 deguonies jonus.

Nustačius koeficientą, gavome 2 kalcio atomus. Kairėje pusėje yra tik vienas. Tai reiškia, kad dabar prieš kalcį turime įdėti 2.

Dabar patikrinkime rezultatą. Jei elemento atomų skaičius yra lygus abiejose pusėse, galime įdėti „lygybės“ ženklą.

Kitas aiškus pavyzdys: kairėje yra du vandeniliai, o po rodyklės taip pat turime du vandenilius.


Visą formulę padauginome iš 2, o dabar vandenilio kiekis pasikeitė. Indeksą padauginame iš koeficiento ir gauname 4. O kairėje pusėje liko du vandenilio atomai. O kad gautume 4, vandenilį turime padauginti iš dviejų.

Taip yra, kai elementas vienoje ir kitoje formulėje yra toje pačioje pusėje iki rodyklės.

Vienas sieros jonas kairėje ir vienas jonas dešinėje. Dvi deguonies dalelės ir dar dvi deguonies dalelės. Tai reiškia, kad kairėje pusėje yra 4 deguonies junginiai. Dešinėje yra 3 deguonies elementai. Tai reiškia, kad vienoje pusėje yra lyginis atomų skaičius, o kitoje - nelyginis skaičius. Jei nelyginį skaičių padauginsime iš dviejų, gausime lyginį skaičių. Pirmiausia mes jį lyginame iki vienodos vertės. Norėdami tai padaryti, padauginkite visą formulę po rodykle iš dviejų. Po padauginimo gauname šešis deguonies jonus, taip pat 2 sieros atomus. Kairėje turime vieną sieros mikrodalelę. Dabar išlyginkime. Mes pateikiame lygtis kairėje prieš pilką 2.

Skambino.
Šis pavyzdys yra sudėtingesnis, nes yra daugiau materijos elementų.

Tai vadinama neutralizacijos reakcija. Ką čia pirmiausia reikia išlyginti:
Išvada rodo, kad visą formulę reikia padauginti iš dviejų.

Dabar pažiūrėkime, kiek sieros yra. Vienas kairėje ir dešinėje pusėse. Atkreipkime dėmesį į deguonį. Kairėje pusėje yra 6 deguonies atomai. Kita vertus – 5. Mažiau dešinėje, daugiau kairėje. Nelyginis skaičius turi būti pakeistas į lyginį skaičių. Norėdami tai padaryti, vandens formulę padauginame iš 2, tai yra, iš vieno deguonies atomo gauname 2.
Dabar dešinėje pusėje jau yra 6 deguonies atomai. Taip pat kairėje pusėje yra 6 atomai. Patikrinkime vandenilį. Du vandenilio atomai ir dar 2 vandenilio atomai. Taigi kairėje pusėje bus keturi vandenilio atomai. Ir kitoje pusėje taip pat yra keturi vandenilio atomai. Visi elementai yra lygūs. Dedame lygybės ženklą.

Kitas pavyzdys.

Čia pavyzdys įdomus, nes atsiranda skliaustai. Jie sako, kad jei koeficientas yra už skliaustų, tada kiekvienas skliausteliuose esantis elementas padauginamas iš jo. Pradėti reikia nuo azoto, nes jo yra mažiau nei deguonies ir vandenilio. Kairėje yra vienas azotas, o dešinėje, atsižvelgiant į skliaustus, yra du.

Dešinėje yra du vandenilio atomai, bet reikia keturių. Mes išeiname iš to paprasčiausiai padauginę vandenį iš dviejų ir gauname keturis vandenilius. Puiku, vandenilis išlygintas. Liko deguonies. Prieš reakciją yra 8 atomai, po - taip pat 8.
Puiku, visi elementai yra lygūs, galime nustatyti „lygūs“.

Paskutinis pavyzdys.

Kitas yra baris. Jis išlygintas, jo liesti nereikia. Prieš reakciją yra du chlorai, po jos yra tik vienas. Ką reikia padaryti? Po reakcijos padėkite 2 priešais chlorą.

Dabar dėl ką tik nustatyto koeficiento po reakcijos gavome du natrius, o prieš reakciją irgi du. Puiku, visa kita išlyginta.

Taip pat galite išlyginti reakcijas naudodami elektroninio balanso metodą. Šis metodas turi keletą taisyklių, pagal kurias jį galima įgyvendinti. Kitas žingsnis yra sutvarkyti visų kiekvienos medžiagos elementų oksidacijos būsenas, kad būtų galima suprasti, kur įvyko oksidacija ir kur redukcija.
Mokytojas, būdamas pagrindinis veikėjas organizuojant mokinių pažintinę veiklą, nuolat ieško būdų, kaip pagerinti mokymosi efektyvumą. Organizuoti efektyvų mokymą galima tik žinant ir sumaniai naudojant įvairias pedagoginio proceso formas.
1. Šiuolaikinis žmogus turi turėti ne tik žinių ir įgūdžių sumą, bet ir gebėjimą suvokti pasaulį kaip vientisą, kompleksinę, nuolat besikeičiančią visumą.
Straipsnis apie chemiją: „Koeficientų išdėstymas cheminėse lygtyse“
Sudarė: chemijos mokytoja
GBOU vidurinė mokykla Nr. 626
Kazutina O.P.
Maskva 2012 m
„Koeficientų išdėstymas cheminėse lygtyse“
Mokytojas, būdamas pagrindinis veikėjas organizuojant mokinių pažintinę veiklą, nuolat ieško būdų, kaip pagerinti mokymosi efektyvumą. Organizuoti efektyvų mokymą galima tik žinant ir sumaniai naudojant įvairias pedagoginio proceso formas.
1. Šiuolaikinis žmogus turi turėti ne tik žinių ir įgūdžių sumą, bet ir gebėjimą suvokti pasaulį kaip vientisą, kompleksinę, nuolat besikeičiančią visumą.
Pasiruošimo pamokai algoritmas
temos pasirinkimas, tikslų apibrėžimas;
turinio pasirinkimas;
nustatyti priemones ir būdus ugdyti teigiamą mokinių motyvacinį požiūrį į darbą klasėje;
pamokos aprūpinimo reikiama vaizdine ir didaktine medžiaga specifikacija;
pamokos plano rengimas
Chemijos pamokos „Koeficientų išdėstymas cheminėje lygtyje“ pavyzdys mokytojams
Tikslas: atsakykite į klausimą: „kodėl cheminėje lygtyje reikia sudėti koeficientus?
Užduotys:
Koeficientų priskyrimo poreikio problema
Koeficientų nustatymo algoritmas
Koeficientų išdėstymo reikšmės įrodymas
Pamokos eiga:
Šiuolaikinis studentas, jei studijuoja, gautas ir apdorojamas žinias traktuoja pragmatiškai. Todėl pateikta medžiaga turėtų logiškai ir glaustai tilpti į galvą.
Kad tai pasiektų, mokytojas visada turėtų atkreipti dėmesį į
Už ką vieną ar kitą veiksmą reikia išmokti klasėje. Tai yra, mokytojas turi paaiškinti. Ir tada, gerąja prasme, laukite tinkamų klausimų nauja tema.Medžiagų masės tvermės dėsnis
Žymus anglų chemikas R. Boyle'as, atviroje retortoje kalcinuodamas įvairius metalus ir svėręs juos prieš ir po kaitinimo, atrado, kad metalų masė tapo didesnė. Remdamasis šiais eksperimentais, jis neatsižvelgė į oro vaidmenį ir padarė neteisingą išvadą, kad medžiagų masė keičiasi dėl cheminių reakcijų. R. Boyle'as teigė, kad egzistuoja kažkokia „ugninė medžiaga“, kuri, kaitinant metalą, susijungia su metalu, padidindama jo masę.
Mg + O 2 MgO
24 g 40 g
M.V.Lomonosovas, skirtingai nei R.Boyle'as, kalcinavo metalus ne po atviru dangumi, o sandariose retortose ir svėrė prieš ir po deginimo. Jis įrodė, kad medžiagų masė prieš ir po reakcijos išlieka nepakitusi ir kalcinuojant į metalą įdedama dalis oro. (Tuo metu deguonis dar nebuvo atrastas.) Šių eksperimentų rezultatus jis suformulavo dėsnio forma: „Visi gamtoje vykstantys pokyčiai yra tokios būsenos, kad viskas, kas paimama iš vieno kūno, dedama į kitą“. Šiuo metu šis įstatymas suformuluotas taip:
Medžiagų, patekusių į cheminę reakciją, masė yra lygi susidariusių medžiagų masei
Mg + O 2 MgO
24 g 32 g 40 g
Klausimas: dėsnis netenkintas (nes pradinės ir galutinės medžiagų masės nėra lygios).
Šios problemos sprendimas yra koeficientų (sveikų skaičių, nurodančių molekulių skaičių) išdėstymas:
2Mg + O 2 2MgO
48 g 32 g 80 g – masės prieš ir po vienodos dėl to, kad elementų atomų skaičius taip pat lygus prieš ir po reakcijos.
Taigi, įrodę studentams masės koeficientų išlyginimo būtinybę, netgi galite apsieiti be kai kurių ankstesnių temų: cheminių medžiagų formulių sudarymas pagal valentiškumą, masės, medžiagos kiekio skaičiavimas... Taip pat pasakojimas apie tai, kad įstatymas medžiagos masės išsaugojimą po 20 metų „iš naujo atrado“ A. Lavoisier, viena vertus, išsiaiškinęs, bet visiškai nekreipdamas dėmesio į M. V. Lomonosovas, turintis etikos problemų, gali būti paliktas savarankiškam tyrimui, pavyzdžiui, ataskaitos forma.
Taigi, norint sėkmingai atlikti tokio pobūdžio užduotis, reikia suprasti sąlygą: atomų skaičius prieš reakciją db yra lygus atomų skaičiui po reakcijos: spręskime kartu:
H 2 S + 3O 2 SO 2 + 2H 2 O (deguonies kiekį padvigubiname dešinėje. Skaičiuojame kairėje)
CH 4 + 2O 2 CO 2 + 2H 2 O
Koeficientus įdėjome į dviejų dujų degimo lygtis
KOEFICENTŲ DIAPAZONAS
Vieno elemento atomų skaičius kairėje lygties pusėje turi būti lygus to elemento atomų skaičiui dešinėje lygties pusėje.
1 užduotis (grupėms).
Nustatykite kiekvieno reakcijoje dalyvaujančio cheminio elemento atomų skaičių.1. Apskaičiuokite atomų skaičių:
a) vandenilis: 8NH3, NaOH, 6NaOH, 2NaOH, H3PO4, 2H2SO4, 3H2S04, 8H2SO4;
6)
deguonies: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.2. Apskaičiuokite atomų skaičių: a)
vandenilis:1) NaOH + HCl 2)CH4+H20 3)2Na+H2
b) deguonis:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Koeficientų išdėstymo cheminių reakcijų lygtyse algoritmas
А1 + О2 → А12О3A1-1 atomas A1-2
O-2 atomas O-3
2. Iš elementų, turinčių skirtingą atomų skaičių kairėje ir dešinėje diagramos dalyse, pasirinkite tą, kurio atomų skaičius yra didesnis
O-2 atomai kairėje
O-3 atomai dešinėje
3. Raskite šio elemento atomų skaičiaus kairėje lygties pusėje ir šio elemento atomų skaičiaus dešinėje lygties pusėje mažiausiąjį bendrąjį kartotinį (LCM).
LCM = 6
4. Padalinkite LCM iš šio elemento atomų skaičiaus kairėje lygties pusėje, gaukite koeficientą kairėje lygties pusėje
6:2 = 3
Al + ZO
2 → Al 2 APIE 35. Padalinkite LCM iš šio elemento atomų skaičiaus dešinėje lygties pusėje, gaukite dešiniosios lygties pusės koeficientą.
6:3 = 2
A1+ O
2 →2A1 2 O36. Jei nustatytas koeficientas pakeitė kito elemento atomų skaičių, tada dar kartą pakartokite 3, 4, 5 veiksmus.
A1 + ZO
2 → →2А1 2 APIE 3A1-1 atomas A1-4
LCM = 4
4:1=4 4:4=1
4A1 + ZO
2 → →2A1 2 APIE 3.
Pirminis žinių įgijimo testas (8-10 min .).Kairėje diagramos pusėje yra du deguonies atomai, o dešinėje - vienas. Atomų skaičius turi būti išlygintas naudojant koeficientus.
1) 2Mg+O
2 → 2MgO2) CaCO
3 + 2HCl→CaCl2 + N2 O + CO22 užduotis
Įdėkite koeficientus į cheminių reakcijų lygtis (atkreipkite dėmesį, kad koeficientas keičia tik vieno elemento atomų skaičių):1. Fe
2 O 3 + A l → A l 2 APIE 3 + Fe; Mg+N 2 → Mg 3 N 2 ;2. Al + S
→ Al 2 S 3 ; A1+ SU → Al 4 C 3 ;3. Al + Cr
2 O 3 → Cr+Al 2 O 3 ; Ca+P → Ca 3 P 2 ;4. C +
H 2 → CH 4 ; Ca + C → SaS 2 ;5. Fe + O
2 → Fe 3 O 4 ; Si+Mg → Mg 2 Si;6/.Na+S
→ Na 2 S; CaO+ SU → CaC 2 + CO;7.Ca+N
2 → C a 3 N 2 ; Si+Cl 2 → SiCl 4 ;8. Ag+S
→ Ag 2 S; N 2 + SU l 2 → NS l;9.N
2 + O 2 → NE; CO 2 + SU → CO ;10. HI →
N 2 → + 1 2 ; Mg+ NS l → MgCl 2 + N 2 ;11.
FeS+ NS 1 → FeCl 2 +H 2 S; Zn+HCl → ZnCl 2 +H 2 ;12. Br
2 +KI → KBr+ I 2 ; Si+HF (r) → SiF 4 +H 2 ;1./HCl+Na
2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+ SO 2 ;14. Cl
2 + KBr → KCl + Br 2 ; SiO 2 + SU → Si + CO;15. SiO
2 + SU → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO16
.3. Ką reiškia „+“ ženklas lygtyje?
4. Kodėl koeficientai dedami į chemines lygtis?
Instrukcijos
Prieš pradėdami pačią užduotį, turite suprasti, kad skaičius, esantis prieš cheminį elementą arba visą formulę, yra koeficientas. Ir šis skaičius yra vertas (ir šiek tiek) indekso. Be to, tai:
Koeficientas taikomas visiems cheminiams simboliams, kurie formulėje pateikiami po jo
Koeficientas padauginamas iš indekso (nesumuojamas!)
Į reakciją patenkančių medžiagų kiekvieno elemento atomų skaičius turi sutapti su šių elementų, įtrauktų į reakcijos produktus, atomų skaičiumi.
Pavyzdžiui, formulės 2H2SO4 užrašymas reiškia 4 H (vandenilio) atomus, 2 S (sieros) atomus ir 8 O (deguonies) atomus.
1. Pavyzdys Nr. 1. Apsvarstykite etileno degimą.
Degant organinėms medžiagoms, susidaro anglies monoksidas (IV) (anglies dioksidas) ir vanduo. Išbandykime koeficientus paeiliui.
C2H4 + O2 => CO2+ H2O
Pradėkime analizuoti. Į reakciją pateko 2 atomai C (anglies), bet buvo gautas tik 1 atomas, o tai reiškia, kad prieš CO2 įdėjome 2 Dabar jų skaičius yra toks pat.
C2H4 + O2 => 2CO2+ H2O
Dabar pažiūrėkime į H (vandenilis). Į reakciją pateko 4 vandenilio atomai, bet rezultatas buvo tik 2 atomai, todėl prieš H2O (vandenį) dedame 2 - dabar taip pat gauname 4
C2H4 + O2 => 2CO2+ 2H2O
Skaičiuojame visus O (deguonies) atomus, susidariusius reakcijos metu (tai yra po lygybės). 4 atomai 2CO2 ir 2 atomai 2H2O – iš viso 6 atomai. Ir prieš reakciją yra tik 2 atomai, tai reiškia, kad mes dedame 3 prieš deguonies molekulę O2, tai reiškia, kad jų taip pat yra 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Taigi rezultatas yra vienodas kiekvieno elemento atomų skaičius prieš ir po lygybės ženklo.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Pavyzdys Nr. 2. Apsvarstykite aliuminio reakciją su praskiesta sieros rūgštimi.
Al + H2SO4 => Al2 (SO4) 3 + H2
Mes žiūrime į S atomus, įtrauktus į Al2 (SO4) 3 - jų yra 3, bet H2SO4 (sieros rūgštyje) yra tik 1, todėl prieš sieros rūgštį taip pat dedame 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Bet dabar prieš reakciją yra 6 H (vandenilio) atomai, o po reakcijos tik 2, tai reiškia, kad mes taip pat dedame 3 prieš H2 (vandenilio) molekulę, kad iš viso gautume 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Galiausiai, mes žiūrime. Kadangi Al2 (SO4) 3 (aliuminio sulfate) yra tik 2 aliuminio atomai, prieš reakciją įdedame 2 prieš Al (aliuminį).
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Dabar visų atomų skaičius prieš ir po reakcijos yra vienodas. Paaiškėjo, kad sudėti koeficientus cheminėse lygtyse nėra taip sunku. Tik pasitreniruok ir viskas susitvarkys.
Naudingi patarimai
Būtinai atminkite, kad koeficientas dauginamas iš indekso, o ne pridedamas.
Šaltiniai:
Daugeliui moksleivių surašykite cheminių reakcijų lygtis ir teisingai jas išdėstykite šansų nelengva užduotis. Be to, kažkodėl pagrindinis sunkumas jiems yra būtent antroji jos dalis. Atrodytų, tame nėra nieko sudėtingo, tačiau kartais studentai pasiduoda, pakliūdami į visišką pasimetimą. Tačiau tereikia atsiminti keletą paprastų taisyklių, ir užduotis nebekels sunkumų.
Instrukcijos
Koeficientas, tai yra skaičius, esantis prieš cheminės molekulės formulę, su visais simboliais ir padauginamas iš kiekvieno simbolio! Jis dauginasi, o ne prideda! Tai gali atrodyti neįtikėtina, tačiau kai kurie mokiniai prideda du skaičius, užuot juos padauginę.
Kiekvieno pradinių medžiagų elemento (ty esančio kairėje lygties pusėje) atomų skaičius turi sutapti su kiekvieno reakcijos produktų elemento atomų skaičiumi (atitinkamai, esančio jo dešinėje).