Съвместимост: жена Везни и мъж Лъв
Представителите на тези зодии не винаги стават близки хора, но са приятни и интересни един на друг. Обединява...
Съединения на желязо(III).
Съединения на желязо (II).
Съединенията на желязото със степен на окисление желязо +2 са нестабилни и лесно се окисляват до производни на желязо (III).
Железен(II) оксид– черен прах, когато е ситно натрошен, е запалим. Кристализира в структурен тип натриев хлорид (гранецентрирана кубична решетка).
Проявява предимно основни свойства. Неразтворим във вода, лесно разтворим в неокисляващи киселини:
FeO + 2HCl = FeCl 2 + H 2 O.
Показва възстановителни свойства:
3FeO + 10HNO 3 = 3Fe(NO 3) 3 + NO + 5H 2 O.
Получава се чрез разлагане на железен (II) оксалат в азотна атмосфера или без достъп на въздух:
FeC 2 O 4 3H 2 O = FeO + 3H 2 O + CO 2 + CO
или в процеса на редукция на железен (III) оксид с водород или въглероден оксид (II):
Fe 2 O 3 + CO = 2FeO + CO 2.
Железен (II) хидроксид Fe(OH) 2когато е прясно утаен, има сивкаво-зелен цвят, не се разтваря във вода, разлага се при температури над 150 ° C и бързо потъмнява поради окисление:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3.
Проявява леки амфотерни свойства с преобладаване на основни и лесно реагира с неокисляващи киселини:
Fe(OH) 2 + 2HCl = FeCl 2 + 2H 2 O.
Реагира с концентрирани алкални разтвори при нагряване, за да образува тетрахидроксоферат (II):
Fe(OH) 2 + 2NaOH = Na 2.
Проявява редуциращи свойства; при взаимодействие с азотна или концентрирана сярна киселина се образуват железни (III) соли:
2Fe(OH) 2 + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 6H 2 O.
Получава се чрез взаимодействие на железни (II) соли с алкален разтвор в отсъствие на атмосферен кислород:
FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4.
Желязни (II) соли.Желязото (II) образува соли с почти всички аниони. Обикновено солите кристализират под формата на зелени кристални хидрати: Fe(NO 3) 2 6H 2 O, FeSO 4 7H 2 O, FeBr 2 6H 2 O, (NH 4) 2 Fe(SO 4) 2 6H 2 O (Mohr's сол) и др.
Публикувано на реф.рф
Солните разтвори имат бледозелен цвят и, поради хидролиза, кисела среда:
Fe 2+ + H 2 O = FeOH + + H +.
Когато стоят на въздух, те бавно се окисляват от разтворен кислород до железни (III) соли:
4FeCl 2 + O 2 + 2H 2 O = 4FeOHCl 2.
Качествена реакция на Fe 2+ катион - взаимодействие с калиев хексацианоферат (III) (червена кръвна сол):
FeSO 4 + K 3 = KFe↓ + K 2 SO 4
Fe 2+ + K + + 3- = KFe↓
В резултат на реакцията се образува синя утайка - желязо (III) - калиев хексацианоферат (II).
Степента на окисление +3 е характерна за желязото.
Железен (III) оксид Fe 2 O 3 –Кафявото вещество съществува в три полиморфни модификации.
Проявява леки амфотерни свойства с преобладаване на основни. Лесно реагира с киселини:
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O.
Не реагира с алкални разтвори, но при топене образува ферити:
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O.
Проявява окислителни и редуциращи свойства. При нагряване се редуцира от водород или въглероден оксид (II), проявявайки окислителни свойства:
Fe 2 O 3 + H 2 = 2FeO + H 2 O,
Fe 2 O 3 + CO = 2FeO + CO 2.
Fe 2 O 3 + 3KNO 3 + 4KOH = 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
При температури над 1400°C се разлага:
6Fe 2 O 3 = 4Fe 3 O 4 + O 2.
Получава се чрез термично разлагане на железен (III) хидроксид:
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
или окисляване на пирит:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
Железен (III) хидроксид Fe(OH) 3 –кристален или аморфно веществокафяв цвят. Подобно на оксида, той проявява слабо изразени амфотерни свойства с преобладаване на основни. Лесно реагира с киселини:
Fe(OH) 3 + 3HCl = FeCl 3 + 3H 2 O.
Реагира с концентрирани разтвори на основи, за да образува хексахидроксоферати (III):
Fe(OH) 3 + 3NaOH = Na 3,
когато се слее с основи или алкални реагенти, образува ферити:
Fe(OH) 3 + NaOH = NaFeO 2 + 2H 2 O,
2Fe(OH) 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2 + 3H 2 O.
В присъствието на силни окислители в алкална среда проявява редуциращи свойства и се окислява до производни на желязо (VI):
2Fe(OH) 3 + 3Br 2 + 10KOH = 2K 2 FeO 4 + 6NaBr + 8H 2 O.
При нагряване се разлага:
Fe(OH) 3 = FeO(OH) + H 2 O,
2FeO(OH) = Fe 2 O 3 + H 2 O.
Получава се чрез взаимодействие на железни (III) соли с алкални разтвори:
Fe 2 (SO 4) 3 + 6NaOH = 2Fe(OH) 3 + 3Na 2 SO 4.
Желязни (III) соли.Желязото (III) образува соли с почти много аниони. Обикновено солите кристализират под формата на кафяви кристални хидрати: Fe (NO 3) 3 6H 2 O, FeCl 3 6H 2 O, NaFe (SO 4) 2 12H 2 O (желязна стипца) и др.
Публикувано на реф.рф
В разтвор солите на желязото (III) са много по-стабилни от солите на желязото (II). Солните разтвори имат жълто-кафяв цвят и, поради хидролиза, кисела среда:
Fe 3+ + H 2 O = FeOH 2+ + H +.
Солите на желязото (III) се хидролизират до в по-голяма степенотколкото соли на желязо (II), поради тази причина солите на желязото (III) и слабите киселини не могат да бъдат изолирани от разтвора; те моментално се хидролизират, за да образуват железен (III) хидроксид:
Fe 2 (SO 4) 3 + 3Na 2 CO 3 + 3H 2 O = 2Fe(OH) 3 + 3CO 2 + 3Na 2 SO 4.
Те проявяват всички свойства на солите.
Те имат предимно възстановителни свойства:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl.
Качествена реакция на Fe 3+ катион - взаимодействие с калиев хексацианоферат (II) (жълта кръвна сол):
FeCl 3 + K 4 = KFe↓ + 3KCl
Fe 3+ + K + + 4- = KFe↓
В резултат на реакцията се образува синя утайка - желязо (II) - калиев хексацианоферат (III).
В същото време йоните на Fe 3+ се определят от характерния кървавочервен цвят на железен (III) тиоцианат, който се образува в резултат на взаимодействието на желязна (III) сол с калиев или амониев тиоцианат:
FeCl 3 + 3KCNS = Fe(CNS) 3 + 3KCl,
Fe 3+ + 3CNS - = Fe(CNS) 3 .
Съединения на желязото (III) - понятие и видове. Класификация и характеристики на категорията "Съединения на желязо (III)" 2014, 2015.
Урок № 5 Спирачна система Тема № 8 Механизми за управление При проектирането на автомобилно оборудване Провеждане на групов урок План - схема Учител на цикъла POPON, подполковник S.A. Fedotov "____"... .
От позиция I спокойно завъртете ключа на 180° в позиция II. Веднага щом стигнете до втора позиция, някои светлини определено ще светнат на арматурното табло. Това може да бъде: предупредителна светлина за зареждане на батерията, аварийна светлина за налягане на маслото,... .
В елинистическата епоха жаждата за помпозност и гротеска в скулптурата се засилва. Някои произведения показват прекомерна страст, а други показват прекомерна близост до природата. По това време те започнаха усърдно да копират статуите от предишни времена; благодарение на копията днес знаем много... .
В Сен Дени е положено началото на френската готическа скулптура. Трите портала на западната фасада на известната църква бяха изпълнени със скулптурни изображения, в които за първи път се прояви желанието за строго обмислена иконографска програма, възникна желание... руска скулптура на втория етаж. XVIII век. Шубин, Козловски, Гордеев, Прокофиев, Шчедрин и др.
Етиен Морис Фалконе (1716-1791) във Франция и Русия (от 1766-1778). „Заплашителният Купидон“ (1757 г., Лувър, Държавен Ермитаж) и неговите реплики в Русия. Паметник на Петър I (1765-1782). Дизайнът и характерът на паметника, неговото значение в градския ансамбъл. Ролята на асистентката на Фалконе - Мари-Ан Коло (1748-1821) в създаването... .
Цели на урока:
Образователни: запознайте учениците с естествените съединения на желязото, разгледайте най-важните съединения на желязото (+2) и (+3), техните свойства, запознайте ги с качествени реакции към железни йони (+2) и (+3), покажете икономическото значение на железни съединения;
Развитие: развитие на речта, паметта, логическото мислене, уменията за съвместна дейност; развитие и затвърждаване на умения и способности за работа с лабораторно оборудване;
Образователни: формиране на мироглед, умения за сътрудничество, приемственост на знанията, осъществяване на междупредметни връзки, образование на екологична грамотност, разумно отношение към природата (слайд 2).
Оборудване и реактиви:
мостри естествени съединенияжелязо (магнитна желязна руда, червена желязна руда, кафява желязна руда, железен пирит); разтвори на железен (II) и (III) хлорид, разтвори на червена кръвна сол и жълта кръвна сол, разтвор на калиев тиоцианат, алкален разтвор; соли: железен сулфат, железен (III) хлорид, железен (III) сулфат, необходимата химическа стъклария.
Тип урок: комбиниран.
По време на часовете
I. Организационен момент.
II. Актуализиране на знанията.
1 вариант
1) Fe + H 2 SO 4р-р =
3) Fe + AgNO 3 =
Вариант 2
Попълнете уравненията на реакцията. Разгледайте уравнение № 2 от гледна точка на OVR.
Вариант 3
Попълнете уравненията на реакцията. Разгледайте уравнение № 2 от гледна точка на OVR.
3) Fe + Cu(NO 3) 2 =
III. Учене на нов материал.
Намиране на желязо в природата
Желязото (5%) е вторият най-разпространен метал в земната кора, а в природата се нарежда на 4-то място. Среща се в природата под формата на оксиди и сулфиди:
Fe 3 O 4 – магнитна желязна руда (магнетит);
Fe 2 O 3 – червена желязна руда (хематит);
(Лекарят и алхимик Теофаст Парацелз пътува много и през 1530 г. от Русия донася в лабораторията си в Базел парче вишневочервен минерал – „кървав камък”. Минералът наистина оставя „кървава” следа – червена линия върху пергамент или бял камък.Помощникът на Парацелз, невеж монах, реши, че минералът от Русия е застоялата кръв на дявола.Посредством приготвянето на компонентите на лекарствата чрез калциниране на соли, получени от „руския минерал“, монахът всеки път получаваше червен прах , Люлякови кристали на железен (III) сулфат и нитрат, жълт железен хлорид ( III) или почти бял карбонат на желязо (II) - всички те, когато се нагряват в поток от въздух, се превръщат в "кървави". След като напусна работата си , монахът започва да разказва навсякъде, че Парацелз е свързан с дявола. Заплахите бяха изсипани срещу известния лекар и през нощта той трябваше тайно да напусне Базел. На сутринта тълпа от жители на града разруши и изгори къщата му).
„Кървав камък“ е минералът хематит Fe 2 O 3 . Солите на желязото се разлагат при нагряване, освобождавайки този червен оксид.)
2Fe 2 O 3 *3H 2 O – кафява желязна руда (лимонит);
FeS 2 – железен пирит (пирит).
Освен желязо, тези минерали съдържат и други елементи. Естественото химически чисто желязо може да има само метеоритен произход (най-големият метеорит е открит през 1920 г. в Югозападна Африка, тегло 60 тона, „Гоба“) (демонстрация на колекция от минерали) (Слайд 3).
Желязото образува няколко серии от съединения, за да разберем кои от тях трябва да запомним, каква е структурната особеност на железния атом и какви степени на окисление са характерни за желязото?
Fe +26 2е, 8е, 14е, 2е
(Fe е елемент от група 7 на вторичната подгрупа, 4 периода (големи). Запълва се не последното, а предпоследното, 3-то от ядрото енергийно ниво, където максималният брой електрони е 18; желязото има 14 електрона.Желязото е редуциращ агент, подобно на други метали, обаче, за разлика от предишните изследвани метали, атомите на желязото по време на окисление се отказват не само от електрони от последното ниво, придобивайки степен на окисление +2, но са способни да дарят 1 електрон от предпоследното енергийно ниво, като същевременно приема степен на окисление +3.Желязото се характеризира с две основни степени на окисление +2 и +3).
Проявявайки степени на окисление +2 и +3, желязото образува 2 серии от съединения.
Съединения на желязото (+2).
Съединения на желязото (+2): FeO (железен (II) оксид и Fe (OH) 2 (железен (II) хидроксид). Те имат ясно изразен основен характер. Получават се индиректно. Разгледайте генетичната серия на Fe +2:
Съединения на желязото (+3).
Съединения на желязото (+3): Fe 2 O 3 (железен (III) оксид) и Fe (OH) 3 (железен (III) хидроксид). Имат слабо изразени амфотерни свойства. Те ги получават индиректно. Помислете за генетичната серия Fe +3:

Железните катиони (+2) лесно се окисляват от атмосферния кислород или други окислители до железни катиони (+3). Следователно бялата утайка Fe (OH) 2 (железен (II) хидроксид) във въздуха първо придобива зелен цвят и след това става кафяв, превръщайки се в Fe (OH) 3 (железен (III) хидроксид (демонстрационен експеримент
)
Железни соли (+2) и (+3).
Желязото образува 2 серии соли Fe +2 и Fe +3. За да разпознаете железните съединения (+2) и (+3), изпълнете качествени реакциикъм тези йони (качествените реакции са реакции, с помощта на които разпознават различни вещества, те са придружени от ярък външен ефект).
Качествени реакции към Fe +2.
Реактивът е червена кръвна сол.
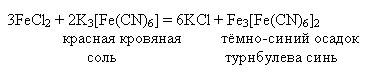
Качествени реакции към Fe +3.
Реактивът е жълта кръвна сол.
Също така, за откриване на железни (III) йони се използва взаимодействието на железни (III) соли с калиев или амониев тиоцианат, в резултат на което разтворът придобива интензивен червен цвят.

Мерки за безопасност: необходимо е веществата да се приемат в количества, определени от учителя; когато данните се появят химични реагентиреагентите върху кожата или дрехите трябва да се измият с излишна вода; Ако нещо попадне в очите ви, изплакнете с вода за 10-15 минути.
(разглеждане на диск; демонстрация на проби от сол; ученически експерименти) (Слайд 4, 5).
Приложение на железни съединения
Желязото изпълнява функциите на хематопоетичните органи и е част от хемоглобина и други сложни протеинови животински организми. Желязото се намира под формата на чугун и стомана широко приложениев националната икономика. От железните соли най-голямо техническо значение имат сулфатите и хлоридите.
FeSO 4 *7H 2 O – железен сулфат се използва за борба с вредители по растенията, за приготвяне на минерални бои и др.;
FeCl 3 – използва се като фиксатор за боядисване на тъкани и като катализатор в органичния синтез;
Fe 2 (SO 4) 3 *9H 2 O - използва се за пречистване на вода, под формата на стипца в медицината.
(разглеждане на диск; демонстрация на проби от сол)
В урока разгледахме съединенията на желязото (+2) и (+3). Научихме за срещането на желязото в природата: минералите магнетит, хематит, лимонит, пирит. Изследвахме железни (+2) съединения (FeO (железен (II) оксид и Fe (OH) 2 (железен (II) хидроксид) и техните свойства; железни (+3) съединения (Fe 2 O 3 (железен (III) оксид) ) и Fe (OH) 3 (железен(III) хидроксид, техните свойства. Разгледахме лекотата на окисляване на Fe +2 до Fe +3 от атмосферния кислород. Научихме, че желязото образува 2 серии от съединения:
Fe +2: реактивът е червена кръвна сол, образува се тъмносиня утайка (Turnboole blue);
Fe +3: служи като реагент
1) жълта кръвна сол, образува се тъмно син цвят (пруско синьо);
2) калиев или амониев тиоцианат, се образува интензивен червен цвят.
Разгледахме използването на железни съединения в металургията, медицината, пречистването на вода, боядисването на текстил, борбата с вредителите и други сектори на националната икономика.
V. Консолидация.
Задача. Каква маса желязо може да се получи чрез третиране на 96 g железен (III) оксид с излишък от въглероден оксид, ако добивът на реакцията е 80% от теоретично възможния? (Слайд 6)

VI. Отражение.
Довършете изреченията или отговорете на въпроса.
Най-много ми хареса...
Днес разбрах...
Беше трудно...
Беше интересно…
Сега мога…
Опитах…
Домашна работа: учебник Габриелян О. С. стр. 14 (стр. 65-67); пр. 5.6 писмено (Слайд 7).
Търсене на пълен текст:
Уникалното информационно съдържание на спектроскопията на Мьосбауер, относителната простота на експеримента и разработените теоретични основи доведоха до широкото използване на спектроскопията на Мьосбауер във физиката и химията на твърдото тяло, ядрената физика, геологията и археологията, аналитичната химия и химическата технология.
1.3 Комплексни железни съединения в разтвор
Желязото, като преходен елемент, е типичен комплексообразовател. Желязото образува стабилен CS, като е във валентно състояние Fe (III) и Fe (II). Комплексообразуването стабилизира съединения със степен на окисление +2, което е по-малко стабилно за желязото.
Желязото образува доста голям брой сложни съединения. Най-характерното за желязото (II) и желязото (III) е координационното число (CN) = 6 (по-рядко 4 и 5). Способността да образува комплекси е по-характерна за желязото при C/O = +3. Нека да разгледаме някои железни комплекси и методите за тяхното приготвяне.
Цианидните комплекси са много стабилни за желязо (II)
(цианоферати (II)). Най-известният от тях е калиев хексацианоферат (II) -жълта кръвна сол.Жълта кръвна сол (калиев хексацианоферат(II) - K
4) е известен от средата на 18 век. Първоначално се получава чрез сливане на отпадъци от кланици (например животинска кръв, копита, кожи и др.) с поташ (K 2 CO 3 ) и железни отпадъци. След охлаждане на стопилката и излужването й с вода се получава жълта кръвна сол.Сега калиев хексацианоферат (II) се получава чрез взаимодействие на излишния KCN върху солта двувалентно желязо:
FeCl 2 + 6KCN = K 4 + 2KC1.
Когато разтвор на жълта кръвна сол се добави към разтвор на железни соли, се образува тъмносиня утайка, т.нар.
Берлинили npycc синьо :4FeCl 3 + 3K 4 = Fe III 4 3 + 12KCl.
снимка. 2. Пруско синьо
3+ .
Ако жълтата кръвна сол се третира с окислител (хлор, калиев перманганат), се получава комплексната сол на фери желязо (III) калиев хексацианоферат (III) - K 3, който е оцветен в червено и се наричачервена кръвна сол.
2K 4 + C1 2 = 2K 3 + 2KC1.

снимка. 1. Червена кръвна сол.
Червена кръвна сол (комплекс 3- ), по-малко стабилен от жълтия (комплекс 4- ), и следователно е много отровен.

Ориз. 5. Енергийна диаграма 4- (МО метод).
Когато разтвори на соли на двувалентно желязо реагират с червена кръвна сол, се образува тъмносиня утайка, т.нар.търнбул синьо:
3FeCl 2 + 4K 3 = Fe III 4 3 + 6KC1 + 6KCN.
Това е качествена реакция към Fe соли 2+ .
Преди това се смяташе, че това ще доведе до образуването на желязо (II) хексацианоферат (III), тоест Fe II 3 2 , това е точно формулата, предложена за “Turnbull blue”. Сега, благодарение на изследване, използващо метода на Mössbauer спектроскопия, е известно, че Turnboole blue и Пруското синьо са едно и също вещество и по време на реакцията електроните се прехвърлят от Fe йони 2+ към хексацианофератен (III) йон:
Fe 2+ + 3- → Fe 3+ + 4- .
Този процес протича почти моментално, а обратната реакция може да се извърши само във вакуум при 300 0 С . Този факт очевидно се обяснява с факта, че комплексът 4- по-стабилен от 3-.
Turnboule blue и Пруското синьо са слабо разтворими във вода, което ги прави трудни за използване като бои. За да се увеличи разтворимостта на хексацианофератите, се въвеждат калиеви йони до състава KFe (последното съединение се нарича разтворимо пруско синьо). С увеличаване на съдържанието на калиеви йони цветът на съединенията се променя от тъмно към светло синьо.
Схема на структурата на разтворимо „пруско синьо“ - „Turnboole blue“ (кристален хидрат от типа KFe III H 2 O) е показано на фигура 6.

Ориз. 6. Пруско синя кристална решетка
Това показва, че Fe атоми 2+ и Fe 3+ са разположени в кристалната решетка от един и същи тип, но по отношение на цианидните групи те са неравностойни, преобладава тенденцията към разполагане на Fe 2+ между въглеродни атоми, Fe 3+ - между азотни атоми, K йони+ и H 2 молекули O са разположени в кухините на кристалната решетка.
Въпреки че съставът, структурата и кристалните решетки на пруското синьо и синьото Turnboule са идентични, различните исторически имена продължават да съществуват, отразявайки химията на железните йони в различни степени на окисление.
Това комплексно съединение се образува при взаимодействието на желязо 3+ с натриев тиосулфат. Комплексното съединение е оцветено в наситено виолетово.
FeCl 3 + 2 Na 2 S 2 O 3 → 3 NaCl + Na
2Na →FeS 2 O 3 + FeS 4 O 6 + Na 2 S 2 O 3
В кисела среда фосфатите и фосфорната киселина с железни йони образуват безцветни комплекси 3-:
FeCl 3 + H 3 PO 4 + K 3 PO 4 → K 3 + 3HCl
Катион 2+ слабо стабилен и незабавно се разгражда от вода:
2+ + 6H 2 O = Fe(OH) 2 ↓ + 4NH 3 ∙H 2 O + 2NH 4 +
Сред високоспиновите Fe комплекси 2+ образувани от монодентатни лиганди включват аква йони 2+ , CS с халидни йони, например K 2, в чиято структура са фиксирани кондензирани октаедри.
Желязото (II) в CS с полидентатни лиганди е нестабилно, тъй като бързо се окислява от атмосферния кислород и вода, превръщайки се в по-термодинамично стабилно желязо (III) CS.
Калиев триоксалатоферат (III) се получава чрез взаимодействие на железен (III) сулфат, бариев оксалат и калиев оксалат във воден разтвор:
Fe 2 (SO 4 ) 3 + Ba 2 (C 2 O 4 ) 2 + 4K 2 C 2 O 4 = 2K 3 + 2BaSO 4 + K 2 SO 4
Под въздействието на светлина с дължина на вълната по-малка от 490 nm, Fe(III) се редуцира количествено до Fe(II) поради окисляването на някои C йони 2 O 4 2- към CO 2:
2K 3 = 2K 2 + K 2 C 2 O 4 + 2CO 2
Полученият железен (II) оксалатен комплекс е силно разтворим във вода и се освобождава от разтвора под формата на кристален хидрат K 2 ∙6H 2 О златисто жълто на цвят.

снимка. 3. Калиев триоксалатоферат (II)
Терминът хелат (английски хелат от гръцки „нокът“) се използва за обозначаване на циклични структури, които се образуват в резултат на добавянето на катион към два или повече донорни атома, принадлежащи към една молекула комплексон. В съответствие с термина хелат, тези съединения трябва да бъдат представени под формата на някакъв вид рак, който с многозъбите си нокти здраво хваща металния йон и колкото повече нокти, толкова по-силен е захватът. Като буквален превод на думата хелат, терминът "съединения с форма на нокът" се използва в литературата до сравнително скоро за обозначаване на комплексни съединения с циклични структури.
Затварянето на циклите по време на образуването на хелатни съединения е важен фактор, отговорен за високата стабилност на комплексонатите. Комплексните съединения, съдържащи циклични групи, са по-стабилни от съединенията, които не съдържат пръстени, а комплексите с пет- и шестчленни пръстени са най-стабилни.
Хелатните комплекси са най-характерни за комплексоните. Терминът "комплексони" е предложен през 1945 г. от професора на Цюрихския университет Г. Шварценбах (1904 - 1978) за органични лиганди от групата на полиаминополикарбоксилните киселини.
Най-често използваният хелатиращ агент е етилендиаминтетраацетат (EDTA, Trilon-B).

Комплекс от желязо с EDTA (- ) се класифицира като нисковъртяща се. Съдържа лиганда EDTA 4- , както обикновено, шестнадесетичен. Въпреки това, CN на Fe йон 3+ е равно на 7, тъй като в допълнение към четири кислородни атома и два азотни атома, EDTA 4- вътрешната сфера на CS включва кислородния атом на хидратиращата вода във вътрешната сфера:

Образуването на хелатни структури е характерно не само за комплексоните, но и за други органични съединения. Например железните CS с бета-дикетони са много стабилни. Най-простият от железните бета-дикетони е триацетилацетонат Fe(AcAc) 3 .

При нагряване сублимира без разлагане. Молекулата му съдържа 3 шестчленни хелатни пръстена. Въпреки че принадлежи към съединения с високо въртене, железният (III) триацетилацетонат се държи като съединение с молекулна структура: йонният компонент на Fe връзката III – лигандът е екраниран от въглеводородни радикали на лиганда, в резултат на което съединението се характеризира със слабо „органоподобно“ междумолекулно взаимодействие. Това обяснява способността му да се разтваря в нискополярни разтворители и лесно да сублимира (150 0 C).
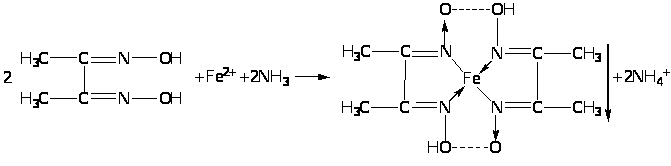
Като неофициална реакция, най-чувствителният реагент за желязо (II) е алкохолен разтвор на диметилглиоксим, който образува червено комплексно хелатно съединение с железен (II) йон, неразтворим в разтвор на амоняк:
1.3.7. Натриев нитропрусид.
Производно на железен (III) хексацианоферат, наречен натриев нитропрусид Na 2 ∙2H 2 O (тъмночервени кристали), може да се получи, например, чрез реакцията :
Na3 + NO = Na2 + NaCN
Таблица 3. Характеристика на комплексните съединения на желязото.
|
Име |
Валентност на желязото |
Състояние на въртене |
D-орбитална схема на разделяне |
|||
|
Тетрафлуороферат(II) |
|
|||||
|
Нитропрусид |
|
|||||
|
Хексакватично желязо (II) |
|
|||||
|
Комплекс с диметилглиоксим (DMG) |
||||||
|
Хексааминирон(II) |
||||||
|
хексацианоферат(II) |
||||||
|
хексацианоферат(III) |
|
|||||
|
Дитиосулфатоферат(III) |
|
|||||
|
Дифосфатоферат (III) |
||||||
|
Триоксалатоферат (III) |
|
|||||
|
Комплекс с EDTA |
|
Първо, трябва да приготвите бариев оксалат, за което добавете разтвор от 2,5 g бариев хлорид дихидрат в 6 ml вода към разтвор от 1,5 g натриев оксалат в 40 ml вода. Филтрирайте утаените кристали с помощта на фуния на Бюхнер и изплакнете няколко пъти. студена вода.
За да получите калиев триоксалатоферат (III), поставете 1,25 g железен (III) сулфат, получения бариев оксалат, 1,5 g калиев оксалат и 30 ml вода в чаша с вместимост 50-100 ml. Загрейте сместа няколко часа на водна баня, като поддържате постоянен обем. След отделяне на утайката от бариев сулфат, филтратът се изпарява до обем 5 ml и се охлажда. Кристалите на калиев триоксалатоферат (III) се филтруват, промиват се с малко количество вода и след това с алкохол и се сушат във вакуумен ексикатор над сярна киселина. Лекарството трябва да се пази от слънчева светлина, сушенето се извършва най-добре на тъмно място.
Пригответе разтвор от 4 g FeCl 3 в 3,5 ml вода и разтвор на 9,3 g EDTA в 30 ml вода. Загрейте сместа за няколко часа на котлона, след което я оставете да изстине. Филтрирайте и изсушете падналите кристали.
При отглеждане на кристали е необходимо да се има предвид, че ако кристализацията протича много бавно, се получава един голям кристал, ако бързо се получават много малки кристали. Веществата, състоящи се от един кристал, са монокристали.
Кристалите се отглеждат по различни начини: например чрез охлаждане на наситен разтвор. С понижаването на температурата разтворимостта на повечето вещества намалява и се казва, че те се утаяват. Първо в разтвора и по стените на съда се появяват малки кристални ядра, след което настъпва кристализация в целия обем на разтвора. Когато охлаждането е бавно и в разтвора няма твърди примеси (например прах), се образуват малко ядра и постепенно те се превръщат в красиви кристали с правилна форма.
Пригответе горещи наситени разтвори на FeCl 3 и жълта кръвна сол. Смесете разтворите в бехерова чаша, филтрирайте утайката с помощта на фуния на Бюхнер и я поставете в чиста филтърна хартия, за да получите зародиш. След една седмица изберете най-големия кристал за засяване, завържете го с конец лавсан и го поставете в майчиния разтвор. След 14 дни се получават по-големи кристали.
Пригответе горещи наситени разтвори на FeSO 4 и червена кръвна сол. Смесете разтворите в бехерова чаша, филтрирайте утайката с помощта на фуния на Бюхнер и я поставете в чиста филтърна хартия, за да получите зародиш. След една седмица изберете най-големия кристал за посев, завържете го с нишка Mylar и го поставете в майчиния разтвор. След 14 дни се получава по-голям кристал, във формата на куб.
1) израсналите кристали имат кубична форма, което отговаря на литературните данни. Когато се гледа през микроскоп, се потвърждава кубичната структура на кристала.
2) цветът на кубичните кристали на "Turnboole blue" и "Prussian blue" е много подобен, което показва идентичността на тяхната структура.
3) тъй като Fe (II) цианидният комплекс е по-стабилен, по време на образуването на "Turnboole blue" възниква валентен преход:
3- + Fe 2+ = Fe 3+ + 4-
4) по този начин се получава преход към по-стабилен цианиден комплекс на Fe (II), т.е. към „пруско синьо“.
5) цветът на полученото комплексно съединение на желязо (III) с EDTA съответства на литературните данни (жълто).
6) цветът на получения калиев триоксалатоферат (III) съответства на литературните данни (оранжево-кафяв).
1) целта на тази работа беше да се установи кубичната структура и идентичността на „Turnboole blue“ - „пруско синьо“.
2) отгледани са кристали Turnbull blue и Prussian blue.
3) визуална инспекцияПолучените кубични кристали показват сходството на формата и цвета на тези кристали, включително и когато се гледат през микроскоп.
4) въз основа на литературни данни се заключава, че поради валентния преход на Fe II 3 2 превърнат в Fe 4 3 , т.е. процесът върви в посока на създаване на по-стабилен Fe (II) комплекс.
5) Получени са 2,32 грама Fe(III) триоксалатоферат, което е 85% от теоретичния добив
6) получава се комплекс от желязо (III) с EDTA
Теория на кристалното поле.
http://www.college.ru/chemistry/course/content/theory.html - WWW, курс „Отворена химия 2.5“, 2007 г.
Налбандян В. Б. Курс на лекции по обща и неорганична химия. – WWW .: Химически факултет, Руски държавен университет, 2002 г.
Голдански В.И. Ефект на Мосбауер. М.: Издателство на Академията на науките на СССР, 1963 г.;
Mössbauer R.L. Резонансно ядрено поглъщане на кванти в твърди веществабез откат. Успехи на физическите науки, 1960, т. 72, бр. 4, стр. 658–671.
И.В. Овчинников, Ю.Г. Галяметдинов. Магнитни течни кристали на базата на координационни съединения. // Рос. хим. и. (J. Руско химическо дружество на името на D.I. Менделеев). – 2001. – т. XLV, No3. – с. 74-79.
Leenson I. Пруско синьо.
http://www.krugosvet.ru/articles/111/1011153/1011153a1.htm - WWW, Енциклопедия Кръгосвет, 2007 г.
Семинар по неорганична химия: учеб. наръчник / ред. В.П. Зломанова. – М.: Издателство на Московския държавен университет, 1994 г. – 320 с.
Мелентьева Г.А. Фармацевтична химия: В 2 т. – М.: “ висше училище”, 1976. – Т.1 – 780 с.; Т. 2. – 827 с.
Беликов В.Г. Фармацевтична химия: Учебник. за фармацевтични ин-тов и фак. пчелен мед. инст. – М.: “Висше училище”, 1985. – 768 с.
Максютина Н. П. и др. Методи за анализ на лекарства, - Киев: Здраве, 1987 г.
Пономарев В.Д. Аналитична химия. – М.: Химия, 1982
Крамаренко В.Ф. Токсикологична химия. – Киев: Вища школа, 1989 – 447 с.
Ръководство за ученика по химия за 8-11 клас. / изд. НЕ. Кузменко, В.В. Eremina - M .: LLC Издателство "ONICS 31 Century": LLC Издателство "Мир и образование", 2003. - 624 с.
Третяков Ю.Д. Неорганична химия. Химия на елементите: учебник за ВУЗ. В 2 книги. - М.: Химия, 2001 - 472 с.
Химическа енциклопедия. В 5 тома. Том 1. / ред. Кнунянца И.Л., Зефирова Н.С., Кулова Н.Н. – М.: Велика руска енциклопедия, 1988 – 624 с.
В.П. Василиев. Комплексони и комплексонати. // Образователно списание на Сорос. – 1996. – № 4. – Стр. 39-44.
Енциклопедия за деца. Том 17. Химия. / глава изд. В. А. Володин. – М.: Аванта+, 2000. – 640 с.
Турова Н.Я., Неорганична химияв таблици. – М.: Висше. хим. кол. РАН, 1999. – 140 с.
Параметри на спектрите на Мьосбауер:
1) Вероятността за ефекта на Мьосбауер в общ случайсе записва във формата:
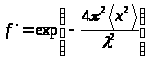
Където<
х
2
> - средният квадрат на изместването на ядрата в абсорбера от равновесното положение по време на вибрации в твърдо състояние по посока на лъча от γ-кванти,л
- дължина на вълната на γ-кванта. величина<х
2
>
зависи от фононния спектър на твърдото тяло и неговата абсолютна температура Т. С повишаване на температурата
Изследване на зависимосттае" върху температурата се използва за установяване на координационни числа, за определяне на фазови преходи и за изследване на характерните динамични параметри на твърди вещества преди и след фазов преход. Този метод е особено ефективен в областта на ниски и свръхниски температури и за некристални вещества, когато рентгеновите дифракционни изследвания обикновено са трудни.
Площите на спектралните линии, наблюдавани експериментално, са пропорционални на концентрацията на изследвания атом в пробата при фиксирана температура. Измерването на тези площи е в основата на използването на Mössbauer спектрометрия за решаване на някои проблеми аналитична химияи фазов анализ на материята.
2) Енергийното изместване на емисионния спектър спрямо абсорбционния спектър се изчислява като сумата от температурното изместванеdT и изомерно отместванед .
Изместването на температурната (доплерова) линия възниква поради промени в енергията на γ-квантите по време на тяхното излъчване и поглъщане в резултат на релативистично изменение на масата съответно на излъчващите и поглъщащите ядра („червено изместване“). Например за 57 Fe очаквано преминаване от стайна температура къмT → 0 е близо до естествената ширина на линията. Тъй като разликите в температурите на източника и поглътителя, по-големи от 300 K, са редки, приносътdT е малка и обикновено се маскира от по-силно изместване, което не зависи от температурата.
За еднакви ядра при липса на електрически и магнитни полета спектърът е еднолинеен (фиг. 7, а).
Изомерното (химично) изместване е свързано с електрическото монополно кулоново взаимодействие между ядрото с радиус на заряд r и електроните на атома:
![]()
Където д
- елементарен заряд,З
-атомен номер, ∆
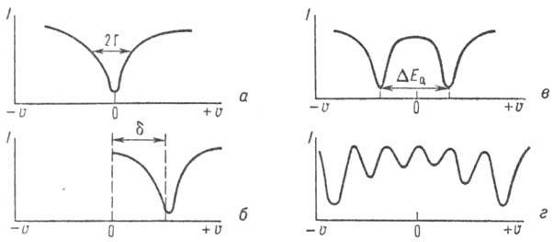
Ориз. 7. Схематично представяне на спектрите на Мьосбауерова резонансна абсорбция на γ-кванти: I е интензитетът на потока от γ-кванти, преминаващ през абсорбера, u е скоростта на движение на източника на γ-кванти спрямо абсорбера; a - резонансна линия при u = 0; b, c, d - изомерно отместване (d), квадруполен дублет (DE Q), съответно магнитна хиперфина структура за 57 Fe ядра.
Стойности δ броени от стандарта, който е приет за спектроскопия на дадено ядро. В този случай се избират съединения, които са химически стабилни и дават прост Мьосбауеров спектър. Например в случай 119 Сн δ се брои от стойността, съответстваща на връзката 119 SnO 2 и за 57 Fe натриев нитропрусид се използва като стандарт.
Големината на химическото изместване може да се използва, за да се прецени разликата в природата на химичните връзки. С помощта на Mössbauer спектроскопия са изследвани голям брой съединения, съставени са номограми, с помощта на коитоδ определят валентността на даден елемент в неизследвани съединения. В зависимост от конфигурацията на валентните електронни обвивки на атомите и йоните могат да се извършват квантово-механични изчисления за свободни атоми. Въпреки това, за атоми в твърди вещества тези изчисления все още са полуколичествени.
3) Електрическото квадруполно взаимодействие възниква поради взаимодействието на квадруполния момент на ядротоQ с градиент на електрическо поле q, създаден от електронната обвивка на атома или кристалната решетка на твърдо тяло, в резултат на което в абсорбционните спектри се наблюдават не една, а няколко линии. Ако спинът на ядротоРезюме >> Маркетинг
... (манганови съединения, жлеза, мед), способност... при спадане на температурата - с римски цифри (I, II, IIIи т.н.). Характерни признацикристално състояние... всички комплексмеханичен Имотиматериал... включват анализ и синтез, индукция и дедукция...
Преобразуван в ангиотензин II, което увеличава... бугорка, амигдалоид комплекс, сливици, екстрапирамидни... на синтезтироксин в щитовидната жлеза жлеза). ... надвива сънотворните Имотимелатонин. ...за 4 дни. IIIгрупа - дневно еднократно...
Със специални Имоти(ретикуларна, ... мрежа и комплексГолджи. ... ЖЛЕЗИЕНДОКРИННА ЧАСТ НА ГЕНИТАЛИЯТА ЖЕЛЯЗОи ПАНКРЕАС ЖЛЕЗИЩитовидна жлеза жлеза ... II-III- IV-V пръсти. Всеки от мен, II, III... невросекреторни клетки протеин- синтезпреобладава и...
Изразен основен Имоти. Катиони жлеза(II) Fe2+ ... цели. За разпознаване на връзки жлеза(II) И ( III) извършват качествени реакции... синтезжелязопорфиринови протеини, хемоглобин и други компоненти на кръвта. Пренася се в кръвта под формата комплекс ...
Позиция на детето ( III). В две... условни рефлекси. II.Стадият на перцептивната психика.. волеви и емоционални Имоти), знак ( синтезотношения и... набор от различни Имотии части. Комплексдействащ... инволюция на гуша жлезии лимфен...
и т.н. IIIопция. ... две (аз и II) подразделения на икономиката... въглища - 30, жлеза- 32, никел... потребителски комплекс. Консуматор комплекснационални...и свръхвисоко качество синтезенергийни ресурси; ... предварително зададени Имоти. Наукоемки...