Сумісність: жінка-Терези та чоловік-Лев
Представники цих знаків зодіаку не завжди стають близькими людьми, але вони один одному приємні та цікаві. Об'єднує...
З'єднання заліза (III)
З'єднання железа (II)
Сполуки заліза зі ступенем окислення заліза +2 малостійкі і легко окислюються до похідних заліза (III).
Оксид заліза (II)– порошок чорного кольору, у дрібнороздробленому стані запалюється. Кристалізується в структурному типі хлориду натрію (кубічні гранецентровані грати).
Виявляє переважно основні властивості. У воді не розчиняється, легко розчиняється в неокислювальних кислотах:
FeO + 2HCl = FeCl 2 + H 2 O.
Виявляє відновлювальні властивості:
3FeO + 10HNO 3 = 3Fe(NO 3) 3 + NO + 5H 2 O.
Виходить розкладанням оксалату железа (II) в атмосфері азоту або без доступу повітря:
FeC 2 O 4 ·3H 2 O = FeO + 3H 2 O + CO 2 + CO
або в процесі відновлення оксиду заліза (III) воднем або оксидом вуглецю (II):
Fe 2 O 3 + CO = 2 FeO + CO 2 .
Гідроксид заліза (II) Fe(OH) 2у свіжоосадженому вигляді має сірувато-зелене забарвлення, у воді не розчиняється, при температурі вище 150 °С розкладається, швидко темніє внаслідок окислення:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 .
Виявляє слабовиражені амфотерні властивості з переважанням базових, легко реагує з неокислюючими кислотами:
Fe(OH) 2 + 2HCl = FeCl 2 + 2H 2 O.
Взаємодіє з концентрованими розчинами лугів при нагріванні з утворенням тетрагідроксоферату (II):
Fe(OH) 2 + 2NaOH = Na 2 .
Виявляє відновлювальні властивості, при взаємодії з азотною або концентрованою сірчаною кислотою утворюються солі заліза (III):
2Fe(OH) 2 + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 6H 2 O.
Виходить при взаємодії солей железа (II) з розчином лугу без кисню повітря:
FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4 .
Солі заліза (II).Железо (II) утворює солі практично з усіма аніонами. Зазвичай солі кристалізуються у вигляді зелених кристалогідратів: Fe(NO 3) 2 ·6H 2 O, FeSO 4 ·7H 2 O, FeBr 2 ·6H 2 O, (NH 4) 2 Fe(SO 4) 2 ·6H 2 O (Сіль Мора) та ін.
Розміщено на реф.
Розчини солей мають блідо-зелене забарвлення і, внаслідок гідролізу, кисле середовище:
Fe 2+ + H 2 O = FeOH + + H +.
При стоянні на повітрі повільно окислюються розчиненим киснем до солей заліза (III):
4FeCl 2 + O 2 + 2H 2 O = 4FeOHCl 2 .
Якісна реакція на катіон Fe 2+ – взаємодія з гексаціаноферратом (III) калію (червоною кров'яною сіллю):
FeSO 4 + K 3 = KFe↓ + K 2 SO 4
Fe 2+ + K + + 3- = KFe↓
в результаті реакції утворюється осад синього кольору - гексаціаноферрат (II) железа (III) - калію.
Ступінь окислення +3 характерна для заліза.
Оксид заліза (III) Fe 2 O 3 –речовина бурого кольору, існує в трьох поліморфних модифікаціях.
Виявляє слабко виражені амфотерні властивості з переважанням базових. Легко реагує з кислотами:
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O.
З розчинами лугів не реагує, але при сплавленні утворює ферити:
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O.
Виявляє окислювальні та відновлювальні властивості. При нагріванні відновлюється воднем або оксидом вуглецю (II), виявляючи окисні властивості:
Fe 2 O 3 + H 2 = 2FeO + H 2 O,
Fe 2 O 3 + CO = 2 FeO + CO 2 .
Fe 2 O 3 + 3KNO 3 + 4KOH = 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
При температурі вище 1400 ° С розкладається:
6Fe 2 O 3 = 4Fe 3 O 4 + O 2 .
Виходить при термічному розкладанні гідроксиду заліза (III):
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
або окисленням піриту:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 .
Гідроксид заліза (III) Fe(OH) 3 –кристалічний або аморфна речовинабурого кольору. Як і оксид, виявляє слабовиражені амфотерні властивості з переважанням базових. Легко реагує з кислотами:
Fe(OH) 3 + 3HCl = FeCl 3 + 3H2O.
Реагує з концентрованими розчинами лугів з утворенням гексагідроксофератів (III):
Fe(OH) 3 + 3NaOH = Na 3 ,
при сплавленні з лугами або лужними реагентами утворює ферити:
Fe(OH) 3 + NaOH = NaFeO 2 + 2H 2 O,
2Fe(OH) 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2 + 3H 2 O.
У присутності сильних окислювачів у лужному середовищі виявляє відновлювальні властивості та окислюється до похідних заліза (VI):
2Fe(OH) 3 + 3Br 2 + 10KOH = 2K 2 FeO 4 + 6NaBr + 8H 2 O.
При нагріванні розкладається:
Fe(OH) 3 = FeO(OH) + H 2 O,
2FeO(OH) = Fe 2 O 3 + H 2 O.
Виходить при взаємодії солей заліза (III) з розчинами лугів:
Fe 2 (SO 4) 3 + 6NaOH = 2Fe(OH) 3 + 3Na 2 SO 4 .
Солі заліза (III).Железо (III) утворює солі практично з багатьма аніонами. Зазвичай солі кристалізуються у вигляді бурих кристалогідратів: Fe(NO 3) 3 ·6H 2 O, FeCl 3 ·6H 2 O, NaFe(SO 4) 2 ·12H 2 O (залізні галун) та ін.
Розміщено на реф.
У розчині солі заліза (III) значно більш стійкі, ніж солі заліза (II). Розчини солей мають жовто-буре забарвлення та, внаслідок гідролізу, кисле середовище:
Fe 3+ + H 2 O = FeOH 2+ + H + .
Солі заліза (III) гідролізують в більшою мірою, ніж солі заліза (II), з цієї причини солі заліза (III) і слабких кислот не можна виділити з розчину, вони миттєво гідролізують з утворенням гідроксиду заліза (III):
Fe 2 (SO 4) 3 + 3Na 2 CO 3 + 3H 2 O = 2Fe(OH) 3 + 3CO 2 + 3Na 2 SO 4 .
Виявляють всі властивості солей.
Мають переважно відновлювальні властивості:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl.
Якісна реакція на катіон Fe 3+ – взаємодія з гексаціаноферратом (II) калію (жовтою кров'яною сіллю):
FeCl 3 + K 4 = KFe↓ + 3KCl
Fe 3+ + K + + 4- = KFe↓
в результаті реакції утворюється осад синього кольору - гексаціаноферрат (III) заліза (II) - калію.
Разом з тим, іони Fe 3+ визначають за характерним криваво-червоним фарбуванням роданіду заліза (III), який утворюється в результаті взаємодії солі заліза (III) з роданідом калію або амонію:
FeCl 3 + 3KCNS = Fe(CNS) 3 + 3KCl,
Fe 3+ + 3CNS - = Fe(CNS) 3 .
З'єднання заліза (III) - поняття та види. Класифікація та особливості категорії "Сполуки заліза (III)" 2014, 2015.
Заняття №5 Гальмівна система Тема №8 Механізми керування Улаштування автомобільної техніки Проведення групового заняття План – конспект Викладач циклу ПОПОН підполковник Федотов С.А. "____"... .
З позиції I спокійно повертаємо ключ на 180 °, позицію II. Як тільки ви потрапите в другу позицію, на щитку приладів обов'язково вмикаються якісь лампочки. Це можуть бути: контрольна лампа заряду акумуляторної батареї, лампочка аварійного тиску масла,... .
В епоху еллінізму в скульптурі посилюється потяг до пишності та гротеску. В одних творах показані надмірні пристрасті, в інших помітна надмірна близькість до натури. У цей час почали старанно копіювати статуї колишнього часу; завдяки копіям ми сьогодні знаємо багато... .
Початки французької готичної скульптури було закладено у Сен-Дені. Три портали західного фасаду знаменитої церкви заповнювали скульптурні зображення, в яких вперше виявилося прагнення суворо продуманої іконографічної програми, виникло бажання... .Руська скульптура друга стать. XVIII ст. Шубін, Козловський, Гордєєв, Прокоф'єв, Щедрін та ін.
Етьєнн Моріс Фальконе (1716-1791) у Франції та Росії (з 1766-1778 р.). "Амур, що загрожує" (1757, Лувр, ГЕ) і його репліки в Росії. Пам'ятник Петру I (1765–1782). Задум і характер пам'ятника, значення їх у міському ансамблі. Роль помічниці Фальконе - Марі-Анн Колло (1748-1821) у створенні... .
Завдання уроку:
Освітня: познайомити учнів із природними сполуками заліза, розглянути найважливіші сполуки заліза (+2) та (+3), їх властивості, ознайомити з якісними реакціями на іони заліза (+2) та (+3), показати народногосподарське значення сполук заліза;
Розвиваюча: розвиток мови, пам'яті, логічного мислення, умінь спільної діяльності; розвиток та закріплення умінь та навичок працювати з лабораторним обладнанням;
Виховна: формування світогляду, навичок співробітництва, спадкоємності знань, здійснення міжпредметних зв'язків, виховання екологічної грамотності, розумного ставлення до природи (слайд 2).
Обладнання та реактиви:
зразки природних сполукзаліза (магнітний залізняк, червоний залізняк, бурий залізняк, залізний колчедан); розчини хлориду заліза (II) та (III), розчини червоної кров'яної солі та жовтої кров'яної солі, розчин роданіду калію, розчин луги; солі: залізний купорос, хлорид заліза (III), сульфат заліза (III), необхідний хімічний посуд.
Тип уроку: комбінований.
Хід уроку
I. Організаційний момент.
ІІ. Актуалізація знань.
1 варіант
1) Fe + H 2 SO 4р-р =
3) Fe + AgNO 3 =
2 варіант
Закінчіть рівняння реакцій. Рівняння №2 розгляньте з погляду ОВР.
3 варіант
Закінчіть рівняння реакцій. Рівняння №2 розгляньте з погляду ОВР.
3) Fe + Cu(NO 3) 2 =
ІІІ. Вивчення нового матеріалу.
Знаходження заліза у природі
Залізо (5%) – другий за поширеністю метал у земної кори, а природі займає 4 місце. У природі зустрічається у вигляді оксидів та сульфідів:
Fe 3 O 4 - магнітний залізняк (магнетит);
Fe 2 O 3 – червоний залізняк (гематит);
(Лікар і алхімік Теофаст Парацельс багато подорожував і в 1530 з Росії привіз у свою лабораторію в м. Базелі шматок вишнево - червоного мінералу - "кровавика". Мінерал дійсно залишав "кривавий" слід - червону межу на пергаменті або білому камені. неосвічений чернець, вирішив, що мінерал з Росії - застигла кров диявола.Готуючи складові частини ліків прожарюванням солей, отриманих з "російського мінералу", чернець щоразу отримував порошок червоного кольору Бузкові кристали сульфату і нітрату заліза (III), жовтий хлорид заліза III) або майже білий карбонат заліза (II) - всі вони при нагріванні в струмі повітря перетворювалися на "кровавик". Кинувши роботу, чернець почав всюди розповідати, що Парацельс пов'язаний з дияволом. покинути Базель.Вранці натовп городян розгромив і спалив його будинок).
"Кровавик" - це мінерал гематит Fe 2 O 3 . Солі заліза при прожарюванні розкладаються з виділенням цього оксиду червоного кольору.)
2Fe 2 O 3 *3H 2 O – бурий залізняк (лимоніт);
FeS 2 – залізний колчедан (пірит).
Крім заліза до цих мінералів входять інші елементи. Природне хімічно чисте залізо буває лише метеоритного походження (найбільший метеорит знайдено 1920 р. у Південно – Західної Африці, вага 60 т., “Гоба”) (демонстрація колекції мінералів) (Cлайд 3).
Залізо утворює кілька рядів сполук, щоб дізнатися, які ми повинні з вами згадати, яка особливість будови атома заліза і які ступеня окиснення характерні для заліза?
Fe +26 2е, 8е, 14е, 2е
(Fe – елемент 7 групи побічної підгрупи, 4 періоди (великий). Заповнюється не останній, а передостанній, 3-й від ядра енергетичний рівень, де максимальна кількість електронів 18, у заліза тут 14 електронів. Залізо відновник, як і інші метали, однак на відміну від раніше вивчених металів, атоми заліза при окисленні віддають не тільки електрони останнього рівня, набуваючи ступеня окислення +2, але здатні до віддачі 1 електрона з передостаннього енергетичного рівня, приймаючи при цьому ступінь окислення +3. Для заліза характерні два основні ступені окислення +2 та +3).
Виявляючи ступеня окислення +2 та +3 залізо утворює 2 ряди сполук.
З'єднання заліза (+2).
З'єднання заліза (+2): FeO (оксид заліза(II) і Fe(OH) 2 (гідроксід заліза(II).) мають яскраво виражений основний характер. Отримують їх побічно.
З'єднання заліза (+3).
З'єднання заліза (+3): Fe 2 Про 3 (оксид заліза(III)) та Fe(OH) 3 (гідроксід заліза(III)). Мають слабко виражені амфотерні властивості. Отримують їх побічно. Розглянемо генетичний ряд Fe+3:

Катіони заліза (+2) легко окислюються киснем повітря або іншими окислювачами до катіонів заліза (+3). Тому білий осад Fe(OH) 2 (гідроксид заліза(II) на повітрі спочатку набуває зеленого забарвлення, а потім стає бурим, перетворюючись на Fe(OH) 3 (гідроксид заліза(III) (демонстраційний досвід).
)
Солі заліза (+2) та (+3).
Залізо утворює 2 ряди солей Fe+2 та Fe+3. Для розпізнавання сполук заліза (+2) та (+3) проводять якісні реакціїна дані іони (якісні реакції – це реакції, за допомогою яких розпізнають різні речовини, Вони супроводжуються яскравим зовнішнім ефектом).
Якісні реакції на Fe+2.
Реактивом є червона кров'яна сіль.
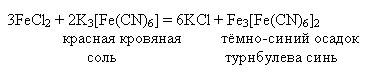
Якісні реакції на Fe+3.
Реактивом є жовта кров'яна сіль.
Також для виявлення іонів заліза(III) використовують взаємодію солей заліза(III) з роданідом калію або амонію, в результаті чого розчин набуває інтенсивно-червоного забарвлення.

Техніка безпеки: необхідно брати речовини у кількостях зазначених учителем; при попаданні даних хімічних реактивівна шкіру чи одяг необхідно змити реактиви надлишком води; якщо щось потрапило у вічі – промити водою протягом 10-15 хвилин.
(перегляд диска; демонстрація зразків солей; досліди учнів) (Cлайд 4, 5).
Застосування сполук заліза
Залізо виконує функції кровотворних органів, входить до складу гемоглобіну, інших білкових складних тварин організмів. У вигляді чавуну та сталі залізо знаходить широке застосуванняу народному господарстві. Із солей заліза найбільше технічне значення мають сульфати та хлориди.
FeSO 4 *7H 2 O – залізний купорос використовується для боротьби зі шкідниками рослин, для приготування мінеральних фарб тощо;
FeCl 3 – використовується як протрава при фарбуванні тканин та як каталізатор в органічному синтезі;
Fe 2 (SO 4) 3 *9H 2 O – застосовують для очищення води у вигляді галунів у медицині.
(перегляд диска; демонстрація зразків солей)
На уроці ми з вами розглянули сполуки заліза (+2) та (+3). Познайомилися зі знаходженням заліза у природі: мінерали магнетит, гематит, лимоніт, пірит. Вивчили сполуки заліза (+2) (FeO (оксид заліза(II) та Fe(OH) 2 (гідроксид заліза(II)) та їх властивості; сполуки заліза (+3) (Fe 2 Про 3 (оксид заліза(III) та Fe) (OH) 3 (гідроксид заліза(III), їх властивості. Розглянули легкість окислення Fe +2 у Fe +3 киснем повітря. Дізналися, що залізо утворює 2 ряди сполук:
Fe +2: реактивом служить червона кров'яна сіль, утворюється темно-синій осад (турнбулева синь);
Fe +3: реактивом служить
1) жовта кров'яна сіль, утворюється темно-синє забарвлення (берлінська блакить);
2) роданід калію або амонію, утворюється інтенсивно-червоне забарвлення.
Розглянули застосування сполук заліза: у металургії, медицині, при очищенні води, при фарбуванні тканин, для боротьби зі шкідниками та інших галузях народного господарства.
V. Закріплення.
Завдання. Яка маса заліза може бути одержана при дії на 96 г оксиду заліза(III) надлишку оксиду вуглецю(II), якщо вихід реакції становить 80% від теоретично можливого? (Cлайд 6)

VI. Рефлексія.
Закінчіть пропозиції або дайте відповідь на поставлене запитання.
Мені найбільше сподобалося.
Сьогодні я дізнався…
Було складно…
Було цікаво…
Тепер я можу…
Я спробував…
Домашнє завдання: підручник Габрієлян О. С. п.14 (стор. 65-67); упр. 5,6 письмово (Cлайд 7).
Повнотекстовий пошук:
Унікальна інформативність мессбауерівської спектроскопії, відносна простота експерименту та розроблені теоретичні основи зумовили широке застосування мессбауерівської спектроскопії у фізиці та хімії твердого тіла, ядерній фізиці, геології та археології, аналітичній хімії, хімічній технології.
1.3 Комплексні сполуки заліза у розчині
Залізо, перехідний елемент, є типовим комплексоутворювачем. Залізо утворює стійкі КС, перебуваючи у валентному стані Fe(III) та Fe(II). Комплексоутворення стабілізує сполуки малостійкого для заліза ступеня окиснення +2.
Залізо утворює досить багато комплексних сполук. Найбільш характерним для заліза (II) та заліза (III) є координаційне число (КЧ) = 6 (рідше 4 та 5). Здатність до комплексоутворення найбільш характерна для заліза С/О = +3. Розглянемо деякі комплекси заліза та методи їх отримання.
Для заліза (II) дуже стійкі ціанідні комплекси.
(ціаноферати (II)). Найбільш відомим з них є гексаціаноферрат (II) калію -жовта кров'яна сіль.Жовта кров'яна сіль (гексаціаноферрат (II) калію) - K
4) відома із середини XVIII століття. Спочатку її отримували сплавленням відходів скотобоєн (наприклад, крові тварин, копит, шкір тощо) з поташем (К 2 З 3 ) та залізними обрізками. Після остигання розплаву та вилуговування його водою отримували жовту кров'яну сіль.Зараз гексаціаноферрат (II) калію одержують, діючи надлишком KCN на солі. двовалентного заліза:
FeCl 2 + 6KCN = K 4 + 2KC1.
При додаванні до розчину солей тривалентного заліза розчину жовтої солі утворюється темно-синій осад, званий
берлінськоїабо npyccкою блакиттю :4FeCl 3 + 3K 4 = Fe III 4 3 + 12KCl.
Фото. 2. Берлінська блакить
3+ .
Якщо на жовту кров'яну сіль подіяти окислювачем (хлором, перманганатом калію), виходить комплексна сіль тривалентного заліза гексаціаноферрат (III) калію - K 3 , яка пофарбована в червоний колір і називаєтьсячервоною кров'яною сіллю.
2K 4 + С1 2 = 2K 3 + 2KC1.

Фото. 1. Червона кров'яна сіль.
Червона кров'яна сіль (комплекс 3- ), менш стійка, ніж жовта (комплекс 4- ), і тому дуже отруйна.

Мал. 5. Енергетична діаграма 4-(метод МО).
При взаємодії розчинів солей двовалентного заліза з червоною кров'яною сіллю утворюється темно-синій осад, що називаєтьсятурнбулеву синю:
3FeCl 2 + 4K 3 = Fe III 4 3 + 6KC1 + 6KCN.
Це - якісна реакція на солі Fe 2+ .
Раніше вважалося, що при цьому утворюється гексаціаноферрат (III) заліза (II), тобто Fe II 3 2 Саме таку формулу пропонували для «турнбулевої сині». Тепер завдяки дослідженням за методом мессбауерівської спектроскопії відомо, що турнбулева синь і берлінська блакитна - одна і та ж речовина, а в процесі реакції відбувається перехід електронів від іонів Fe 2+ до гексаціаноферрат (III)-іону:
Fe 2+ + 3- → Fe 3+ + 4- .
Цей процес відбувається практично миттєво, а зворотну реакцію можна здійснити лише у вакуумі при 300 0 З. Цей факт пояснюється, мабуть, тим, що комплекс 4- більш стійкий, ніж 3-.
Турнбулева синь і берлінська блакит погано розчиняються у воді, що ускладнює їх використання у вигляді фарб. Для підвищення розчинності гексаціанофератів вводять іони калію аж до складу KFe (остання сполука називається розчинною берлінською блакиттю). У міру збільшення вмісту іонів калію колір сполук змінюється від темно-до світло-синього.
Схема структури розчинної «берлінської лазурі» – «турнбульової сині» (кристалогідрат виду KFe III · H 2 O) наведено малюнку 6 .

Мал. 6. Кристалічні грати «берлінської лазурі»
З неї видно, що атоми Fe 2+ та Fe 3+ розташовуються в кристалічній решітці однотипно, проте по відношенню до ціанідних груп вони нерівноцінні, переважає тенденція до розміщення Fe 2+ між атомами вуглецю, Fe 3+ - між атомами азоту, іони До+ та молекули H 2 O розташовуються в порожнинах кристалічної решітки.
Хоча склад, структура та кристалічні грати берлінської лазурі та турнбулевої сині ідентичні, різні історичні назви продовжують зберігатися, відбиваючи хімію іонів заліза у різних ступенях окислення.
Ця комплексна сполука утворюється при взаємодії заліза 3+ з тіосульфатом натрію. Комплексне з'єднання пофарбоване в інтенсивний фіолетовий колір.
FeCl 3 + 2 Na 2 S 2 O 3 → 3 NaCl + Na
2Na →FeS 2 O 3 + FeS 4 O 6 +Na 2 S 2 O 3
У кислому середовищі фосфати та фосфорна кислота з іонами заліза утворюють безбарвні комплекси 3-:
FeCl 3 + H 3 PO 4 + K 3 PO 4 → K 3 + 3HCl
Катіон 2+ малостійкий і водою миттєво розкладається:
2+ + 6H 2 O = Fe(OH) 2 ↓ + 4NH 3 ∙H 2 O + 2NH 4 +
До високоспинових комплексів Fe 2+ , утворених монодентантними лігандами, відносяться акваіони 2+ , КС з галогенід-іонами, наприклад, K 2, у структурі якого зафіксовані конденсовані октаедри.
Залізо (II) у КС з полідентантними лігандами нестійке, оскільки швидко окислюється киснем повітря та водою, переходячи в більш термодинамічно стабільні КС заліза (III).
Триоксалатоферрат (III) калію отримують при взаємодії сульфату заліза (III), оксалату барію, і оксалату калію у водному розчині:
Fe 2 (SO 4 ) 3 + Ba 2 (C 2 O 4 ) 2 + 4K 2 C 2 O 4 = 2K 3 + 2BaSO 4 + K 2 SO 4
Під дією світла із довжиною хвилі менше 490 нм Fe(III) кількісно відновлюється до Fe(II) за рахунок окислення частини іонів C 2 O 4 2- до CO 2 :
2K 3 = 2K 2 + K 2 C 2 O 4 + 2CO 2
Оксалатний комплекс заліза (II), що утворюється при цьому, добре розчинний у воді, і виділяється з розчину у вигляді кристалогідрату K 2 ∙6H 2 O золотисто-жовтого кольору.

Фото. 3. Тріоксалатоферрат (II) калію
Термін хелат (англ. chelate від грецького «клешня») прийнятий для позначення циклічних структур, які утворюються в результаті приєднання катіону до двох або більше донорних атомів, що належать одній молекулі комплексону. Відповідно до терміну хелат ці сполуки слід представляти у вигляді якогось краба, який своїми полідентатними клешнями міцно захоплює іон металу, і чим більше клешнів, тим міцніше захоплення. Як буквальний переклад слова chelate у літературі до порівняно недавнього часу для позначення комплексних сполук з циклічними структурами використовувався термін "клешнеподібні сполуки".
Замикання циклів при утворенні хелатних сполук є важливим фактором, що зумовлює високу стабільність комплексонатів. Комплексні сполуки, що містять циклічні угруповання, відрізняються більш високою міцністю, ніж сполуки, що не містять циклів, а найбільшу стійкість мають комплекси з п'яти- і шестичленними циклами.
Хелатні комплекси найбільш характерні для комплексонів. Термін «комплексони» запропонований в 1945 професором Цюріхського університету Г. Шварценбахом (1904 - 1978) для органічних лігандів групи поліамінополікарбонових кислот.
Найчастіше використовуваним комплексоном є етилендіамінтетраацетат (ЕДТА, трилон-Б).

Комплекс заліза з ЕДТА (- ) належить до низькоспінових. У ньому ліганд ЕДТА 4- , як завжди, гексадентантен. Однак, КЧ іона Fe 3+ дорівнює 7, оскільки, крім чотирьох атомів кисню та двох атомів азоту, ЕДТА 4- у внутрішню сферу КС входить атом кисню внутрішньосферної гідратної води:

Освіта хелатних структур характерне як для комплексонів, але інших органічних сполук. Наприклад, дуже стійкі КС заліза із бета-дикетонами. Найпростіший із бета-дикетонів заліза – трисацетилацетонат Fe(AcAc) 3 .

Під час нагрівання сублімується без розкладання. У його молекулі є 3 шестичленні хелатні цикли. Незважаючи на приналежність до високоспинових сполук, трисацетилацетонат заліза (III) поводиться як сполука з молекулярною структурою: іонна складова зв'язку Fe III – ліганд екранується вуглеводневими радикалами ліганду, внаслідок чого для сполуки характерна слабка «органоподібна» міжмолекулярна взаємодія. Це пояснює його здатність розчинятися в малополярних розчинниках та легко сублімуватися (150 0 С).
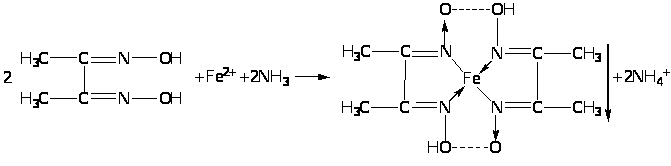
В якості неофіційних реакцій найбільш чутливим реактивом на залізо (II) є спиртовий розчин диметилгліоксиму, який утворює із заліза (II) іоном комплексне хелатне з'єднання червоного кольору, нерозчинне в розчині аміаку:
1.3.7. Нітропрусид натрію.
Похідне гексаціаноферату (III) заліза, зване нітропрусидом натрію Na 2 ∙2H 2 O (кристали темно-червоного кольору), можна отримати, наприклад, по реакції :
Na 3 + NO = Na 2 + NaCN
Таблиця 3. Характеристика комплексних з'єднань заліза.
|
Назва |
Валентність заліза |
Спиновий стан |
Схема розщеплення d-орбіталей |
|||
|
Тетрафтороферрат (II) |
|
|||||
|
Нітропрусид |
|
|||||
|
Гексаакважелезо (II) |
|
|||||
|
Комплекс з диметилгліоксимом (ДМГ) |
||||||
|
Гексааммінзалізо (II) |
||||||
|
гексаціаноферрат(II) |
||||||
|
гексаціаноферрат(III) |
|
|||||
|
Дітіосульфатоферрат (III) |
|
|||||
|
Дифосфатоферрат (III) |
||||||
|
Тріоксалатоферрат (III) |
|
|||||
|
Комплекс з ЕДТА |
|
Спочатку необхідно приготувати оксалат барію, для чого до розчину 1,5 г натрію оксалату в 40 мл води прилити розчин 2,5 г дигідрату хлориду барію в 6 мл води. Кристали, що випали, відфільтрувати на вирві Бюхнера і промити кілька разів холодною водою.
Для отримання триоксалатоферрату (III) калію в склянку ємністю 50-100 мл помістити 1,25 г сульфату заліза (III), одержаний оксалат барію, 1,5 г оксалату калію і 30 мл води. Нагрівати суміш протягом кількох годин на водяній бані підтримуючи постійний об'єм. Після відокремлення осаду сульфату барію упарити фільтрат до об'єму 5 мл і охолодити. Кристали триоксалатоферрату (III) калію відфільтрувати, промити невеликою кількістю води, а потім спиртом і висушити у вакуум-ексикаторі над сірчаною кислотою. Препарат слід захищати від сонячного світла, сушіння краще виробляти у темному місці.
Приготувати розчин 4 г FeCl 3 у 3,5 мл води та розчин 9,3 г ЕДТА у 30 мл води. Нагрівати суміш протягом кількох годин на плитці, потім дати охолонути. Кристали, що випали, відфільтрувати і висушити.
При вирощуванні кристалів необхідно враховувати, що якщо кристалізація йде дуже повільно, виходить один великий кристал, якщо швидко - безліч дрібних кристалів. Речовини, що складаються з одного кристала, – монокристали.
Вирощують кристали різними способами: наприклад, охолоджуючи насичений розчин. Зі зниженням температури розчинність більшості речовин зменшується, і вони, як то кажуть, випадають в осад. Спочатку в розчині та на стінках судини з'являються крихітні кристали-зародки, а потім йде кристалізація по всьому об'єму розчину. Коли охолодження повільне, а в розчині немає твердих домішок (скажімо, пилу), зародків утворюється небагато, і поступово вони перетворюються на красиві кристали правильної форми.
Приготувати гарячі насичені розчини FeCl 3 та жовтої кров'яної солі. Розчини змішати в хімічній склянці, осад, що випав, відфільтрувати на вирві Бюхнера і помістити в чистий фільтрувальний папір для отримання затравки. Через тиждень вибрати найбільший кристал для затравки, обв'язати його лавсанової ниткою і помістити в маточний розчин. Через 14 днів були отримані більші кристали.
Приготувати гарячі насичені розчини FeSO 4 та червоної кров'яної солі. Розчини змішати в хімічній склянці, осад, що випав, відфільтрувати на вирві Бюхнера і помістити в чистий фільтрувальний папір для отримання затравки. Через тиждень вибрати найбільший кристал для затравки, обв'язати його лавсанової ниткою і поміщають у маточний розчин. Через 14 днів одержують більший кристал, у формі куба.
1) вирощені кристали мають кубічну форму, що відповідає літературним даним. Під час розгляду через мікроскоп підтверджується кубічна структура кристала.
2) забарвлення кубічних кристалів "турнбулевої сині"-"берлінської блакиті" дуже близька, що вказує на ідентичність їх структури.
3) оскільки стійкішим є ціанідний комплекс Fe (II), то при утворенні "турнбулевої сині" відбувається валентний перехід:
3- + Fe 2+ = Fe 3+ + 4-
4) таким чином здійснюється перехід до більш стійкого ціанідного комплексу Fe (II), тобто до "берлінської блакиті".
5) забарвлення отриманої комплексної сполуки заліза (III) з ЕДТА відповідає літературним даним (жовте).
6) забарвлення отриманого триоксалатоферрата (III) калію відповідає літературним даним (оранжево-коричневе).
1) метою даної роботи було встановити кубічну структуру та ідентичність "турнбулевої сині"-"берлінської блакиті".
2) вирощені кристали турнбулевої сині та берлінської блакиті.
3) візуальний оглядотриманих кубічних кристалів свідчить про близькість форми та забарвлення цих кристалів, у тому числі і під час огляду через мікроскоп.
4) зроблено висновок на підставі літературних даних, що за рахунок валентного переходу Fe II 3 2 перетворюється на Fe 4 3 , Т. е. процес йде у напрямку створення більш стійкого комплексу Fe (II).
5) отримано 2,32 грама триоксалатоферату Fe(III), що становить 85% від теоретичного виходу
6) отримано комплекс заліза (III) з ЕДТА
Теорія кристалічного поля.
http://www.college.ru/chemistry/course/content/theory.html - WWW, курс «Відкрита Хімія 2.5», 2007
Налбандян В. Б. Курс лекцій з загальної та неорганічної хімії. - WWW.: Хімічний факультет РГУ, 2002.
Гольданський В.І. Ефект Мессбауера. М: Вид-во АН СРСР, 1963;
Месбауер Р.Л. Резонансне ядерне поглинання квантів у твердих тілахбез віддачі. Успіхи фізичних наук, 1960, т. 72, вип. 4, с. 658-671.
І.В. Овчинніков, Ю.Г. Галяметдінов. Магнітні рідкі кристали з урахуванням координаційних сполук. // Ріс. хім. ж. (Ж. Рос. хім. про-ва ім. Д.І. Менделєєва). - 2001. - Т. XLV, №3. - С. 74-79.
Леєнсон І. Лазур берлінська.
http://www.krugosvet.ru/articles/111/1011153/1011153a1.htm - WWW, енциклопедія «Кругосвіт», 2007.
Практикум з неорганічної хімії: Навч. посібник / за ред. В.П. Зломанів. - М.: Вид-во МДУ, 1994 - 320с.
Мелентьєва Г.А. Фармацевтична хімія: У 2 т. - М: " вища школа”, 1976. - Т.1 - 780 с.; Т. 2. - 827 с.
Бєліков В.Г. Фармацевтична хімія: Навч. для фармац. ін-тів та фак. мед. ін-тов. - М.: "Вища школа", 1985. - 768 с.
Максютіна Н.П та ін. Методи аналізу ліків, - Київ: Здоров'я,1987
Пономарьов В.Д. аналітична хімія. - М.: Хімія, 1982
Крамаренко В.Ф. Токсикологічна хімія. – Київ: Вища школа, 1989 р. – 447 с.
Довідник школяра з хімії 8-11 клас. / За ред. Н.Є. Кузьменко, В.В. Єрьоміна – М.: ТОВ «Видавничий дім «ОНІКС 31 століття»: ТОВ «Видавництво «Світ та Освіта», 2003. – 624 с.
Третьяков Ю.Д. Неорганічна хімія. Хімія елементів: підручник для вишів. У 2 книгах. – М.: Хімія, 2001 – 472с.
Хімічна енциклопедія У 5 томах. Том 1. / За ред. Кнунянца І.Л., Зефірова Н.С., Кулова Н.М. - М.: Велика російська енциклопедія, 1988 - 624 с.
В.П. Васильєв. Комплексони та комплексонати. // Соросівський освітній журнал. - 1996. - № 4. - с. 39-44.
Енциклопедія для дітей Том 17. Хімія. / Глав. ред. В. А. Володін. - М.: Аванта +, 2000. - 640 с.
Турова Н.Я., Неорганічна хіміяу таблицях. - М.: Вищ. хім. кол. РАН, 1999. - 140 с.
Параметри месбауерівських спектрів:
1) Імовірність ефекту Мессбауера в загальному випадкузаписується у вигляді:
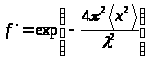
де<
x
2
>- середній квадрат зміщення ядер у поглиначі з положення рівноваги при твердотільних коливаннях у напрямку пучка γ-квантів,l
-довжина хвилі γ-кванта. Величина<х
2
>
залежить від фононного спектру твердого тіла та його абсолютної температур Т. Зі зростанням температури
Дослідження залежностейf" від температури використовують при встановленні координаційних чисел для визначення фазових переходів і вивчення характерних динамічних параметрів твердих тіл до і після фазового переходу. Особливо ефективний цей метод у сфері низьких і наднизьких температур і для некристалічних речовин, коли, як правило, утруднені рентгеноструктурні дослідження.
Площі спектральних ліній, що спостерігаються експериментально, пропорційні концентрації атома, що досліджується, в зразку при фіксованій температурі. На вимірі цих площ засноване застосування мессбауерівської спектрометрії для вирішення деяких завдань аналітичної хіміїта фазового аналізу речовини.
2)Енергетичний зсув спектра випромінювання щодо спектра поглинання обчислюється як сума температурного зсувуdT та ізомерного зсувуd .
Температурний (доплерівський) зсув лінії виникає внаслідок зміни енергії γ-квантів при їх випромінюванні та поглинанні в результаті релятивістської зміни маси випромінюючих та поглинаючих ядер відповідно ("червоне зміщення"). Наприклад, для 57 Fe очікуване зміщення при переході від кімнатної температури доТ → 0 наближається до природної ширини лінії. Оскільки відмінність у температурах джерела та поглинача більше 300 К зустрічається рідко, внесокdT малий і зазвичай маскується сильнішим зрушенням, яке від температури не залежить.
Для тотожних ядер без електричних і магнітних полів спектр є одиночну лінію (рис. 7, а).
Ізомерний (хімічний) зсув пов'язаний з електричною монопольною кулонівською взаємодією між ядром із зарядовим радіусом r і електронами атома:
![]()
де е
-Елементарний заряд,Z
-атомний номер, ∆
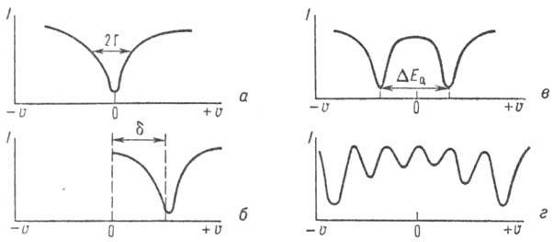
Мал. 7. Схематичне зображення спектрів месбауерівського резонансного поглинання γ-квантів: I-інтенсивність потоку γ-квантів, що пройшли через поглинач, u -швидкість руху джерела γ-квантів щодо поглинача; а – резонансна лінія при u = 0; б, в, г - ізомерний зсув (d), квадрупольний дублет (DE Q), магнітна надтонка структура для ядер 57 Fe.
Значення δ відраховують від стандарту, прийнятого для спектроскопії даного ядра. При цьому вибирають сполуки, що стабільні хімічно і дають простий месбауеровський спектр. Наприклад, у разі 119 Sn δ відраховується від значення, що відповідає з'єднанню 119 SnO 2 , а для 57 Fe як стандарт використовують нітропрусид натрію.
За величиною хімічного зсуву можна будувати висновки про відмінності у характері хімічних зв'язків. За допомогою мессбауерівської спектроскопії вивчено велику кількість сполук, складені номограми, за допомогою якихδ визначають валентність елемента у невивчених сполуках. Залежно від конфігурації валентних електронних оболонок атомів та іонів можуть бути проведені квантово-механічні розрахунки для вільних атомів. Однак для атомів у твердих тілах ці розрахунки мають поки що напівкількісний характер.
3) Електрична квадрупольна взаємодія виникає внаслідок взаємодії квадрупольного моменту ядраQ з градієнтом електричного поля q, створюваного електронною оболонкою атома або кристалічною решіткою твердого тіла, у результаті спектрів поглинання спостерігається не одна, а кілька ліній. Якщо спин ядраКонспект >> Маркетинг
... (з'єднань марганцю, заліза, міді), здатністю... при зниженні температури - римськими цифрами (I, II, IIIі т.д.). Характерні ознакикристалічного стану... весь комплексмеханічних властивостейматеріалу... включають аналіз та синтез, індукцію та дедукцію...
Перетворюється на ангіотензин II, який збільшує... бугра, амігдалоїдного комплексу, мигдалин, екстрапірамідної... на синтезтироксину в щитовидній залізі). ... долає снодійні властивостімелатоніну. ... протягом 4-х діб. IIIгрупа - щоденне одноразове...
Зі спеціальними властивостями(ретикулярна, ... мережею та комплексомГольджі. ... ЗАЛІЗИЕНДОКРИННА ЧАСТИНА ПІДЛОВИХ ЗАЛІЗта підшлункової ЗАЛІЗИЩитоподібна заліза ... II-III- IV-V пальцям. Кожна з I, II, III... нейросекреторних клітинах протеїно- синтезпереважає, а...
Виражені основні властивості. Катіони заліза(II) Fe2+ ... цілях. Для розпізнавання з'єднань заліза(II) та ( III) проводять якісні реакції... синтезузалізопорфіринових білків гемоглобіну та інших складових крові. У крові воно переноситься у формі комплексу ...
Позиція Дитини ( III). В двох... умовних рефлексів. II.Стадія перцептивної психіки ... вольових та емоційних властивостей), характер ( синтезвідносин і... сукупності різних властивостейта частин. Комплексдіючих... інволюція зобної залозита лімфатичного...
Т. буд. IIIваріант. ... двох (I та II) підрозділів господарства... вугілля - 30, заліза- 32, нікелю... споживчий комплекс. Споживчий комплекснаціональної... та надвисокоякісний синтезенергоносіїв; ... заздалегідь заданими властивостями. Застосовуються наукомісткі...