Interpretação das cartas de tarô: o laço do Diabo e seu significado no layout
Quantas vezes vemos esse monstro com chifres de cabra quando distribuímos cartas de Tarô. "Diabo" é a personificação do inferno e da morte...
Lições objetivas:
Educacional: apresentar aos alunos os compostos naturais de ferro, considerar os compostos de ferro mais importantes (+2) e (+3), suas propriedades, familiarizá-los com as reações qualitativas aos íons de ferro (+2) e (+3), mostrar o significado econômico de compostos de ferro;
Desenvolvimento: desenvolvimento da fala, memória, pensamento lógico, habilidades de atividade conjunta; desenvolvimento e consolidação de competências e habilidades para trabalhar com equipamentos de laboratório;
Educacional: formação de uma visão de mundo, habilidades de cooperação, continuidade de conhecimentos, implementação de conexões interdisciplinares, educação de alfabetização ambiental, atitude razoável em relação à natureza (slide 2).
Equipamentos e reagentes:
amostras compostos naturais ferro (minério de ferro magnético, minério de ferro vermelho, minério de ferro marrom, pirita de ferro); soluções de cloreto de ferro (II) e (III), soluções de sal de sangue vermelho e sal de sangue amarelo, solução de tiocianato de potássio, solução alcalina; sais: sulfato de ferro, cloreto de ferro (III), sulfato de ferro (III), vidraria química necessária.
Tipo de aula: combinada.
Durante as aulas
I. Momento organizacional.
II. Atualizando conhecimentos.
1 opção
1) Fe + H 2 SO 4р-р =
3) Fe + AgNO 3 =
opção 2
Complete as equações de reação. Considere a equação nº 2 do ponto de vista do OVR.
Opção 3
Complete as equações de reação. Considere a equação nº 2 do ponto de vista do OVR.
3) Fe + Cu(NÃO 3) 2 =
III. Aprendendo novo material.
Encontrando ferro na natureza
O ferro (5%) é o segundo metal mais comum em crosta da terrra, e na natureza ocupa o 4º lugar. Ocorre na natureza na forma de óxidos e sulfetos:
Fe 3 O 4 – minério de ferro magnético (magnetita);
Fe 2 O 3 – minério de ferro vermelho (hematita);
(O médico e alquimista Theofastus Paracelsus viajou muito e em 1530 da Rússia trouxe para seu laboratório em Basileia um pedaço de mineral vermelho cereja - “pedra de sangue”. O mineral realmente deixou um traço “sangrento” - uma linha vermelha no pergaminho ou pedra branca. Assistente de Paracelso, um monge ignorante, decidiu que o mineral da Rússia era o sangue coagulado do diabo. Ao preparar os componentes dos medicamentos por meio da calcinação de sais obtidos do “mineral russo”, o monge recebia cada vez um pó vermelho . Cristais lilases de sulfato e nitrato de ferro (III), cloreto férrico amarelo ( III) ou carbonato de ferro (II) quase branco - todos eles, quando aquecidos em uma corrente de ar, se transformaram em “sangrentos". Tendo abandonado o trabalho , o monge começou a dizer em todos os lugares que Paracelso estava associado ao diabo. Ameaças foram feitas contra o famoso médico, e à noite ele teve que deixar secretamente Basileia. De manhã, uma multidão de moradores da cidade destruiu e queimou sua casa).
“Bloodstone” é o mineral hematita Fe 2 O 3 . Os sais de ferro se decompõem quando aquecidos, liberando esse óxido vermelho.)
2Fe 2 O 3 *3H 2 O – minério de ferro marrom (limonita);
FeS 2 – pirita de ferro (pirita).
Além do ferro, esses minerais contêm outros elementos. O ferro natural quimicamente puro só pode ser originário de meteorito (o maior meteorito foi encontrado em 1920 no sudoeste da África, pesando 60 toneladas, “Goba”) (demonstração de uma coleção de minerais) (Slide 3).
O ferro forma diversas séries de compostos, para saber quais devemos lembrar, qual a característica estrutural do átomo de ferro e quais estados de oxidação são característicos do ferro?
Fe +26 2е, 8е, 14е, 2е
(Fe é um elemento do grupo 7 do subgrupo secundário, 4 períodos (grande). Não é o último, mas o penúltimo, 3º do nível de energia do núcleo que é preenchido, onde o número máximo de elétrons é 18; o ferro tem 14 elétrons. O ferro é um agente redutor, como outros metais, porém, ao contrário dos metais previamente estudados, os átomos de ferro durante a oxidação cede não apenas os elétrons do último nível, adquirindo um estado de oxidação de +2, mas são capazes de doar 1 elétron de o penúltimo nível de energia, embora aceite um estado de oxidação de +3. O ferro é caracterizado por dois graus principais de oxidação (+2 e +3).
Exibindo estados de oxidação +2 e +3, o ferro forma 2 séries de compostos.
Compostos de ferro (+2).
Compostos de ferro (+2): FeO (óxido de ferro (II) e Fe (OH) 2 (hidróxido de ferro (II)). Eles têm um caráter básico pronunciado. Eles são obtidos indiretamente. Considere a série genética de Fe +2:
Compostos de ferro (+3).
Compostos de ferro (+3): Fe 2 O 3 (óxido de ferro(III)) e Fe(OH) 3 (hidróxido de ferro(III)). Eles têm propriedades anfotéricas fracamente expressas. Eles os recebem indiretamente. Considere a série genética Fe +3:

Os cátions de ferro (+2) são facilmente oxidados pelo oxigênio atmosférico ou outros agentes oxidantes em cátions de ferro (+3). Portanto, o precipitado branco Fe(OH) 2 (hidróxido de ferro(II)) no ar primeiro adquire uma cor verde e depois torna-se marrom, transformando-se em Fe(OH) 3 (hidróxido de ferro(III) (experimento de demonstração
)
Sais de ferro (+2) e (+3).
O ferro forma 2 séries de sais Fe +2 e Fe +3. Para reconhecer compostos de ferro (+2) e (+3), são realizadas reações qualitativas nesses íons (reações qualitativas são reações com a ajuda das quais eles reconhecem várias substâncias, são acompanhados por um efeito externo brilhante).
Reações qualitativas ao Fe +2.
O reagente é sal de sangue vermelho.

Reações qualitativas ao Fe +3.
O reagente é sal de sangue amarelo.
Além disso, para detectar íons de ferro (III), utiliza-se a interação dos sais de ferro (III) com o tiocianato de potássio ou de amônio, fazendo com que a solução adquira uma cor vermelha intensa.

Cuidados de segurança: é necessário ingerir substâncias em quantidades especificadas pelo professor; quando os dados chegam reagentes químicos os reagentes na pele ou na roupa devem ser lavados com excesso de água; Se alguma coisa entrar em contato com seus olhos, enxágue com água por 10 a 15 minutos.
(visualização do disco; demonstração de amostras de sal; experimentos dos alunos) (Slide 4, 5).
Aplicação de compostos de ferro
O ferro desempenha as funções dos órgãos hematopoiéticos e faz parte da hemoglobina e de outras proteínas complexas de organismos animais. O ferro é encontrado na forma de ferro fundido e aço ampla aplicação na economia nacional. Dos sais de ferro, os sulfatos e cloretos são os de maior importância técnica.
FeSO 4 *7H 2 O – sulfato de ferro é utilizado no controle de pragas de plantas, no preparo de tintas minerais, etc.;
FeCl 3 – utilizado como mordente para tingimento de tecidos e como catalisador em síntese orgânica;
Fe 2 (SO 4) 3 *9H 2 O - utilizado para purificação de água, na forma de alúmen na medicina.
(visualização do disco; demonstração de amostras de sal)
Na lição, examinamos os compostos de ferro (+2) e (+3). Aprendemos sobre a ocorrência do ferro na natureza: os minerais magnetita, hematita, limonita, pirita. Estudamos compostos de ferro (+2) (FeO (óxido de ferro(II) e Fe(OH) 2 (hidróxido de ferro(II)) e suas propriedades; compostos de ferro (+3) (Fe 2 O 3 (óxido de ferro(III) ) e Fe (OH) 3 (hidróxido de ferro (III), suas propriedades. Observamos a facilidade de oxidação de Fe +2 em Fe +3 pelo oxigênio atmosférico. Aprendemos que o ferro forma 2 séries de compostos:
Fe +2: o reagente é sal de sangue vermelho, forma-se um precipitado azul escuro (azul Turnboole);
Fe +3: serve como reagente
1) sal de sangue amarelo, forma-se uma cor azul escura (azul da Prússia);
2) tiocianato de potássio ou amônio, forma-se uma cor vermelha intensa.
Examinamos o uso de compostos de ferro na metalurgia, medicina, purificação de água, tingimento de têxteis, controle de pragas e outros setores da economia nacional.
V. Consolidação.
Tarefa. Que massa de ferro pode ser obtida tratando 96 g de óxido de ferro(III) com excesso de monóxido de carbono se o rendimento da reação for 80% do teoricamente possível? (Slide 6)

VI. Reflexão.
Complete as frases ou responda à pergunta.
eu gostei mais...
Hoje eu descobri...
Foi difícil...
Foi interessante…
Agora eu posso…
Tentei…
Lição de casa: livro didático Gabrielyan O. S. p. 14 (pp. 65-67); ex. 5.6 por escrito (Slide 7).
Pesquisa de texto completo:
O conteúdo informativo único da espectroscopia Mössbauer, a relativa simplicidade do experimento e os fundamentos teóricos desenvolvidos levaram ao uso generalizado da espectroscopia Mössbauer em física e química do estado sólido, física nuclear, geologia e arqueologia, química analítica e tecnologia química.
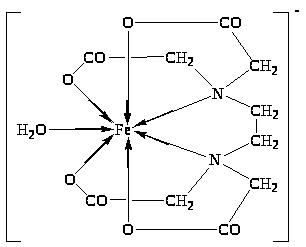
1.3 Compostos complexos de ferro em solução
O ferro, sendo um elemento de transição, é um agente complexante típico. O ferro forma CS estável, estando nos estados de valência Fe (III) e Fe (II). A complexação estabiliza compostos com um estado de oxidação de +2 que é menos estável para o ferro.
O ferro forma um número bastante grande de compostos complexos. O mais característico do ferro (II) e do ferro (III) é o número de coordenação (CN) = 6 (menos frequentemente 4 e 5). A capacidade de formar complexos é mais característica do ferro em C/O = +3. Vejamos alguns complexos de ferro e métodos para sua preparação.
Os complexos de cianeto são muito estáveis para o ferro (II)
(cianoferratos (II)). O mais famoso deles é o hexacianoferrato (II) de potássio -sal de sangue amarelo.Sal de sangue amarelo (hexacianoferrato de potássio (II) - K
4) é conhecido desde meados do século XVIII. Inicialmente, era obtido pela fusão de resíduos de matadouros (por exemplo, sangue animal, cascos, peles, etc.) com potássio (K 2CO3 ) e restos de ferro. Após resfriar o fundido e lixiviá-lo com água, obteve-se sal de sangue amarelo.Agora, o hexacianoferrato de potássio (II) é obtido pela reação do excesso de KCN com o sal ferro ferroso:
FeCl2 + 6KCN = K4 + 2KC1.
Quando uma solução de sal de sangue amarelo é adicionada a uma solução de sais férricos, forma-se um precipitado azul escuro, denominado
Berlim ou npycc azul :4FeCl 3 + 3K 4 = Fe III 4 3 + 12KCl.
Foto. 2. Azul da Prússia
3+ .
Se o sal amarelo do sangue for tratado com um agente oxidante (cloro, permanganato de potássio), obtém-se o sal complexo de ferro férrico (III) hexacianoferrato de potássio (III) - K 3, que é colorido em vermelho e chamadosal de sangue vermelho.
2K 4 + C1 2 = 2K 3 + 2KC1.

Foto. 1. Sal vermelho no sangue.
Sal vermelho de sangue (complexo 3- ), menos estável que o amarelo (complexo 4- ) e, portanto, é muito venenoso.

Arroz. 5. Diagrama de energia 4- (método MO).
Quando soluções de sais de ferro divalentes reagem com o sal vermelho do sangue, forma-se um precipitado azul escuro, denominadoturnbull azul:
3FeCl 2 + 4K 3 = Fe III 4 3 + 6KC1 + 6KCN.
Esta é uma reação qualitativa aos sais de Fe 2+ .
Anteriormente acreditava-se que isso resultaria na formação de hexacianoferrato (III) de ferro (II), ou seja, Fe II 3 2 , esta é exatamente a fórmula proposta para “Turnbull blue”. Agora, graças à pesquisa pelo método de espectroscopia Mössbauer, sabe-se que o azul Turnboole e o azul da Prússia são a mesma substância e, durante a reação, os elétrons são transferidos dos íons Fe 2+ para íon hexacianoferrato (III):
Fe 2+ + 3- → Fe 3+ + 4- .
Este processo ocorre quase instantaneamente, e a reação inversa só pode ser realizada no vácuo a 300 0 COM . Este fato é aparentemente explicado pelo fato do complexo 4- mais estável que 3-.
O azul Turnboule e o azul da Prússia são pouco solúveis em água, o que os torna difíceis de usar como tintas. Para aumentar a solubilidade dos hexacianoferratos, íons de potássio são introduzidos na composição KFe (este último composto é denominado azul da Prússia solúvel). À medida que o conteúdo de íons potássio aumenta, a cor dos compostos muda de azul escuro para azul claro.
Esquema da estrutura do “azul da Prússia” solúvel - “Turnboole blue” (hidrato cristalino do tipo KFe IIIH2 O) é mostrado na Figura 6.

Arroz. 6. Estrutura de cristal azul da Prússia
Isso mostra que os átomos de Fe 2+ e Fe 3+ estão localizados na rede cristalina do mesmo tipo, porém, em relação aos grupos cianeto são desiguais, prevalece a tendência à colocação de Fe 2+ entre átomos de carbono, Fe 3+ - entre átomos de nitrogênio, íons K moléculas + e H 2 O estão localizados nos vazios da rede cristalina.
Embora a composição, estrutura e redes cristalinas do azul da Prússia e do azul Turnboule sejam idênticas, diferentes nomes históricos continuam a persistir, refletindo a química dos íons de ferro em diferentes estados de oxidação.
Este composto complexo é formado pela interação do ferro 3+ com o tiossulfato de sódio. O composto complexo é de cor violeta intensa.
FeCl 3 + 2 Na 2 S 2 O 3 → 3 NaCl + Na
2Na →FeS 2 O 3 + FeS 4 O 6 + Na 2 S 2 O 3
Em ambiente ácido, fosfatos e ácido fosfórico com íons de ferro formam complexos incolores 3-:
FeCl 3 + H 3 PO 4 + K 3 PO 4 → K 3 + 3HCl
Cátion 2+ fracamente estável e instantaneamente decomposto pela água:
2+ + 6H 2 O = Fe(OH) 2 ↓ + 4NH 3 ∙H 2 O + 2NH 4 +
Entre os complexos de Fe de alta rotação 2+ formados por ligantes monodentados incluem íons água 2+ , CS com íons haleto, por exemplo, K 2, em cuja estrutura são fixados octaedros condensados.
O ferro (II) em CS com ligantes polidentados é instável, pois é rapidamente oxidado pelo oxigênio atmosférico e pela água, transformando-se em ferro (III) CS mais termodinamicamente estável.
O trioxalatoferrato (III) de potássio é preparado pela reação de sulfato de ferro (III), oxalato de bário e oxalato de potássio em uma solução aquosa:
Fe 2 (SO 4 ) 3 + Ba 2 (C 2 O 4 ) 2 + 4K 2 C 2 O 4 = 2K 3 + 2BaSO 4 + K 2 SO 4
Sob a influência da luz com comprimento de onda inferior a 490 nm, o Fe(III) é quantitativamente reduzido a Fe(II) devido à oxidação de alguns íons C 2 O 4 2- para CO 2:
2K 3 = 2K 2 + K 2 C 2 O 4 + 2CO 2
O complexo de oxalato de ferro (II) resultante é altamente solúvel em água e é liberado da solução na forma de hidrato cristalino K 2∙6H2 Ó de cor amarelo dourado.

Foto. 3. Trioxalatoferrato de potássio (II)
O termo quelato (quelato inglês do grego “garra”) é usado para designar estruturas cíclicas que são formadas como resultado da adição de um cátion a dois ou mais átomos doadores pertencentes a uma molécula de complexona. De acordo com o termo quelato, esses compostos deveriam ser representados na forma de uma espécie de caranguejo, que, com suas garras polidentadas, agarra firmemente o íon metálico, e quanto mais garras, mais forte é a pegada. Como tradução literal da palavra quelato, o termo “compostos em forma de garra” foi usado na literatura até recentemente para designar compostos complexos com estruturas cíclicas.
O fechamento dos ciclos durante a formação de compostos quelatos é um importante fator responsável pela alta estabilidade dos complexonatos. Compostos complexos contendo grupos cíclicos são mais estáveis do que compostos que não contêm anéis, e complexos com anéis de cinco e seis membros são os mais estáveis.
Os complexos quelatos são mais típicos das complexonas. O termo “complexonas” foi proposto em 1945 pelo professor da Universidade de Zurique G. Schwarzenbach (1904 - 1978) para ligantes orgânicos do grupo dos ácidos poliaminopolicarboxílicos.
O agente quelante mais comumente usado é o etilenodiaminotetraacetato (EDTA, Trilon-B).

Complexo de ferro com EDTA (- ) é classificado como de baixo spin. Contém o ligante EDTA 4- , como sempre, hexadentante. No entanto, o CN do íon Fe 3+ é igual a 7, pois, além de quatro átomos de oxigênio e dois átomos de nitrogênio, o EDTA 4- a esfera interna do CS inclui o átomo de oxigênio da água de hidratação da esfera interna:
A formação de estruturas quelatadas é característica não apenas das complexonas, mas de outros compostos orgânicos. Por exemplo, CSs de ferro com betadicetonas são muito estáveis. A mais simples das betadicetonas de ferro é o trisacetilacetonato Fe(AcAc) 3 .

Quando aquecido, sublima sem se decompor. Sua molécula contém 3 anéis quelatos de seis membros. Apesar de pertencer a compostos de alto spin, o trisacetilacetonato de ferro (III) se comporta como um composto com estrutura molecular: o componente iônico da ligação Fe III – o ligante é protegido pelos radicais hidrocarbonetos do ligante, como resultado o composto é caracterizado por uma interação intermolecular fraca “semelhante a um órgão”. Isso explica sua capacidade de dissolver em solventes de baixa polaridade e sublimar facilmente (150 0ºC).
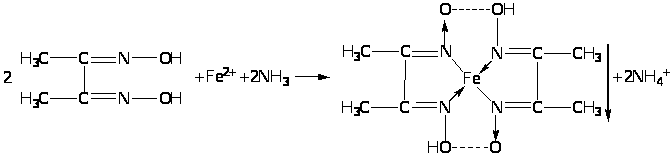
Como reação informal, o reagente mais sensível para o ferro (II) é uma solução alcoólica de dimetilglioxima, que forma um composto quelato complexo vermelho com o íon ferro (II), insolúvel em solução de amônia:
1.3.7. Nitroprussiato de sódio.
Um derivado do hexacianoferrato de ferro (III) chamado nitroprussiato de sódio Na 2∙2H2 O (cristais vermelho-escuros), pode ser obtido, por exemplo, pela reação :
Na 3 + NO = Na 2 + NaCN
Mesa 3. Características dos compostos complexos de ferro.
|
Nome |
Valência do ferro |
Estado de rotação |
Esquema de divisão orbital D |
|||
|
Tetrafluoroferrato(II) |
|
|||||
|
Nitroprussiato |
|
|||||
|
Ferro hexaquático (II) |
|
|||||
|
Complexo com dimetilglioxima (DMG) |
||||||
|
Hexaamminiron(II) |
||||||
|
hexacianoferrato (II) |
||||||
|
hexacianoferrato (III) |
|
|||||
|
Ditiossulfatoferrato (III) |
|
|||||
|
Difosfatoferrato(III) |
||||||
|
Trioxalatoferrato(III) |
|
|||||
|
Complexo com EDTA |
|
Primeiro você precisa preparar oxalato de bário, para o qual adicione uma solução de 2,5 g de cloreto de bário di-hidratado em 6 ml de água a uma solução de 1,5 g de oxalato de sódio em 40 ml de água. Filtrar os cristais precipitados utilizando um funil de Buchner e enxaguar várias vezes. água fria.
Para obter trioxalatoferrato (III) de potássio, coloque 1,25 g de sulfato de ferro (III), o oxalato de bário resultante, 1,5 g de oxalato de potássio e 30 ml de água em um copo com capacidade de 50-100 ml. Aqueça a mistura por várias horas em banho-maria, mantendo um volume constante. Após separação do precipitado de sulfato de bário, evaporar o filtrado até um volume de 5 ml e arrefecer. Os cristais de trioxalatoferrato de potássio (III) são filtrados, lavados com uma pequena quantidade de água e depois com álcool e secos em dessecador a vácuo sobre ácido sulfúrico. O medicamento deve ser protegido da luz solar, é melhor secar em local escuro.
Prepare uma solução de 4 g FeCl 3 em 3,5 ml de água e uma solução de 9,3 g de EDTA em 30 ml de água. Aqueça a mistura por várias horas no fogão e depois deixe esfriar. Filtre e seque os cristais caídos.
Ao cultivar cristais, é necessário levar em consideração que se a cristalização ocorrer muito lentamente, obtém-se um cristal grande; se for rápido, obtêm-se muitos cristais pequenos. Substâncias que consistem em um cristal são monocristais.
Os cristais crescem de diferentes maneiras: por exemplo, resfriando uma solução saturada. À medida que a temperatura diminui, a solubilidade da maioria das substâncias diminui e diz-se que precipitam. Primeiro, minúsculos núcleos cristalinos aparecem na solução e nas paredes do recipiente, e então a cristalização ocorre em todo o volume da solução. Quando o resfriamento é lento e não há impurezas sólidas na solução (digamos, poeira), poucos núcleos são formados e gradualmente eles se transformam em belos cristais de formato regular.
Prepare soluções saturadas quentes de FeCl 3 e sal de sangue amarelo. Misture as soluções em um béquer, filtre o precipitado com funil de Buchner e coloque em papel de filtro limpo para obter uma semente. Depois de uma semana, selecione o cristal maior para semear, amarre-o com fio lavsan e coloque-o na solução mãe. Após 14 dias, foram obtidos cristais maiores.
Prepare soluções saturadas quentes de FeSO 4 e sal de sangue vermelho. Misture as soluções em um béquer, filtre o precipitado com funil de Buchner e coloque em papel de filtro limpo para obter uma semente. Após uma semana, selecione o cristal maior para semear, amarre-o com fio Mylar e coloque-o na solução mãe. Após 14 dias, obtém-se um cristal maior, em forma de cubo.
1) os cristais cultivados possuem formato cúbico, o que corresponde aos dados da literatura. Quando visto através de um microscópio, a estrutura cúbica do cristal é confirmada.
2) a cor dos cristais cúbicos de “azul Turnboole” e “azul da Prússia” é muito semelhante, o que indica a identidade de sua estrutura.
3) como o complexo cianeto de Fe(II) é mais estável, durante a formação do “Turnboole blue” ocorre uma transição de valência:
3- + Fe 2+ = Fe 3+ + 4-
4) assim, ocorre uma transição para um complexo de cianeto de Fe (II) mais estável, ou seja, para o “azul da Prússia”.
5) a cor do composto complexo resultante de ferro (III) com EDTA corresponde aos dados da literatura (amarelo).
6) a cor do trioxalatoferrato de potássio (III) resultante corresponde aos dados da literatura (laranja-marrom).
1) o objetivo deste trabalho foi estabelecer a estrutura cúbica e a identidade do “Turnboole blue” - “Prussian blue”.
2) foram cultivados cristais de azul Turnbull e azul da Prússia.
3) inspeção visual Os cristais cúbicos obtidos indicam a semelhança da forma e da cor desses cristais, inclusive quando vistos ao microscópio.
4) concluiu-se com base em dados da literatura que devido à transição de valência do Fe II 3 2 convertido para Fe 4 3 , ou seja, o processo segue no sentido de criar um complexo de Fe (II) mais estável.
5) Foram obtidos 2,32 gramas de trioxalatoferrato de Fe(III), o que representa 85% do rendimento teórico
6) foi obtido um complexo de ferro (III) com EDTA
Teoria do campo cristalino.
http://www.college.ru/chemistry/course/content/theory.html - WWW, curso “Open Chemistry 2.5”, 2007
Nalbandyan V. B. Curso de palestras sobre química geral e inorgânica. – WWW.: Faculdade de Química, Universidade Estatal Russa, 2002.
Goldansky V.I. Efeito Mossbauer. M.: Editora da Academia de Ciências da URSS, 1963;
Mössbauer R.L. Absorção nuclear ressonante de quanta em sólidos sem recuo. Uspekhi Fizicheskikh Nauk, 1960, v. 4, pág. 658–671.
4. Ovchinnikov, Yu.G. Galyametdinov. Cristais líquidos magnéticos baseados em compostos de coordenação. //Ross. química. e. (J. Sociedade Química Russa em homenagem a D.I. Mendeleev). – 2001. – volume XLV, nº 3. – pp. 74-79.
Leenson I. Azul da Prússia.
http://www.krugosvet.ru/articles/111/1011153/1011153a1.htm - WWW, enciclopédia Krugosvet, 2007.
Workshop de química inorgânica: Proc. manual/ed. V.P. Zlomanova. – M.: Editora da Universidade Estadual de Moscou, 1994 – 320 p.
Melentyeva G.A. Química Farmacêutica: Em 2 volumes – M.: “ pós-graduação”, 1976. – T.1 – 780 pp.; T. 2. – 827 p.
Belikov V.G. Química Farmacêutica: Livro didático. para produtos farmacêuticos in-tov eu falo. mel. Inst. – M.: “Escola Superior”, 1985. – 768 p.
Maksyutina N. P. e outros Métodos de análise de medicamentos, - Kiev: Saúde, 1987
Ponomarev V.D. Química Analítica. – M.: Química, 1982
Kramarenko V.F. Química toxicológica. – Kiev: Escola Vyshcha, 1989 - 447 p.
Guia do aluno de Química para as séries 8 a 11. /ed. NÃO. Kuzmenko, V.V. Eremina - M.: Editora LLC "ONICS 31 Century": Editora LLC "Paz e Educação", 2003. - 624 p.
Tretyakov Yu.D. Química Inorgânica. Química dos elementos: livro didático para universidades. Em 2 livros. - M.: Química, 2001 - 472 p.
Enciclopédia Química. Em 5 volumes. Volume 1./ed. Knunyantsa I.L., Zefirova N.S., Kulova N.N. – M.: Grande Enciclopédia Russa, 1988 – 624 p.
V.P. Vasiliev. Complexonas e complexonatos. // Revista educacional Soros. – 1996. – Nº 4. – pág. 39-44.
Enciclopédia para crianças. Volume 17. Química. / capítulo Ed. V. A. Volodin. – M.: Avanta+, 2000. – 640 p.
Turova N.Ya., Química Inorgânica em tabelas. –M.: Superior. química. col. RAS, 1999. – 140 p.
Parâmetros dos espectros de Mössbauer:
1) A probabilidade do efeito Mössbauer em caso Geral está escrito na forma:

Onde<
x
2
> - o quadrado médio do deslocamento dos núcleos no absorvedor da posição de equilíbrio durante vibrações do estado sólido na direção do feixe de γ-quanta,eu
- comprimento de onda do quantum γ. Magnitude<х
2
>
depende do espectro de fônons do sólido e de sua temperatura absoluta T. Com o aumento da temperatura
Pesquisa de Dependênciaf" na temperatura é usado para estabelecer números de coordenação, para determinar transições de fase e para estudar os parâmetros dinâmicos característicos de sólidos antes e depois de uma transição de fase. Este método é especialmente eficaz na região de temperaturas baixas e ultrabaixas e para substâncias não cristalinas, quando os estudos de difração de raios X são geralmente difíceis.
As áreas das linhas espectrais observadas experimentalmente são proporcionais à concentração do átomo em estudo na amostra a uma temperatura fixa. A medição dessas áreas é a base para o uso da espectrometria Mössbauer para resolver alguns problemas química Analítica e análise de fase da matéria.
2) A mudança de energia do espectro de emissão em relação ao espectro de absorção é calculada como a soma da mudança de temperaturadT e mudança isoméricad .
O deslocamento da linha de temperatura (Doppler) ocorre devido a mudanças na energia dos γ-quanta durante sua emissão e absorção como resultado de uma mudança relativística na massa dos núcleos emissores e absorventes, respectivamente ("desvio para o vermelho"). Por exemplo, para 57 Fe esperava mudança da temperatura ambiente paraT → 0 está próximo da largura natural da linha. Como as diferenças nas temperaturas da fonte e do sumidouro superiores a 300 K são raras, a contribuiçãodT é pequeno e geralmente é mascarado por uma mudança mais forte, que não depende da temperatura.
Para núcleos idênticos na ausência de campos elétricos e magnéticos, o espectro é uma única linha (Fig. 7, a).
O deslocamento do isômero (químico) está associado à interação monopolo elétrica de Coulomb entre o núcleo com raio de carga r e os elétrons do átomo:
![]()
Onde e
-carga elementar,Z
-número atômico, ∆
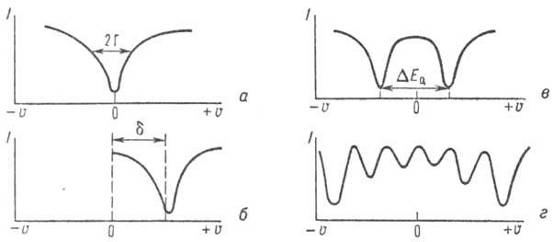
Arroz. 7. Representação esquemática dos espectros de absorção ressonante de Mössbauer de γ-quanta: I é a intensidade do fluxo de γ-quanta passando pelo absorvedor, u é a velocidade de movimento da fonte de γ-quanta em relação ao absorvedor; a - linha de ressonância em u = 0; b, c, d - deslocamento de isômero (d), dupleto quadrupolo (DE Q), estrutura magnética hiperfina para núcleos de 57 Fe, respectivamente.
Valores δ contado a partir do padrão aceito para espectroscopia de um determinado núcleo. Neste caso, são selecionados compostos que são quimicamente estáveis e fornecem um espectro Mössbauer simples. Por exemplo, no caso 119Sn δ é contado a partir do valor correspondente à conexão 119 SnO 2, e para 57 Fe nitroprussiato de sódio é usado como padrão.
A magnitude do deslocamento químico pode ser usada para julgar a diferença na natureza das ligações químicas. Usando a espectroscopia Mössbauer, um grande número de compostos foram estudados, nomogramas foram compilados, com a ajuda dos quaisδ determinar a valência de um elemento em compostos não estudados. Dependendo da configuração das camadas eletrônicas de valência de átomos e íons, cálculos de mecânica quântica podem ser realizados para átomos livres. No entanto, para átomos em sólidos estes cálculos ainda são semiquantitativos.
3) A interação elétrica quadrupolo surge devido à interação do momento quadrupolo do núcleoP com um gradiente de campo elétrico q criado pela camada de elétrons de um átomo ou pela rede cristalina de um sólido, como resultado não uma, mas várias linhas são observadas nos espectros de absorção. Se o spin do núcleoResumo >> Marketing
... (compostos de manganês, glândula, cobre), habilidade... quando a temperatura cai - em algarismos romanos (I, II, III etc.). Sinais característicos estado cristalino...todos complexo mecânico propriedades material... inclui análise e síntese, indução e dedução...
Convertido em angiotensina II, que aumenta... tuberosidade, amigdaloide complexo, amígdalas, extrapiramidais... em síntese tiroxina na tireóide glândula). ... supera pílulas para dormir propriedades melatonina. ...por 4 dias. III grupo - diariamente uma vez...
Com especial propriedades(reticular, ... rede e complexo Golgi. ... GLÂNDULAS PARTE ENDÓCRINA DO GENITAL FERRO e PÂNCREAS GLÂNDULAS Tireoide glândula ... II-III- dedos IV-V. Cada um de mim, II, III... células neurossecretoras de proteínas- síntese prevalece e...
Básico expresso propriedades. Cátions glândula(II) Fe2+ ... propósitos. Para reconhecer conexões glândula(II) E ( III) realizar reações qualitativas... síntese proteínas de ferroporfirina, hemoglobina e outros componentes do sangue. É transportado no sangue na forma complexo ...
Posição da criança ( III). Em dois... reflexos condicionados. II.O estágio da psique perceptiva... volitivo e emocional propriedades), personagem ( síntese relacionamentos e... um conjunto de diferentes propriedades e peças. Complexo agindo... involução de bócio glândulas e linfático...
Etc. III opção. ... dois (eu e II) divisões da economia... carvão - 30, glândula- 32, níquel... consumidor complexo. Consumidor complexo nacional...e de altíssima qualidade síntese recursos energéticos; ... predefinido propriedades. Intensivo em ciência...
Compostos de ferro (III)
Compostos de ferro (II)
Compostos de ferro com estado de oxidação de ferro +2 são instáveis e facilmente oxidados em derivados de ferro (III).
Óxido de ferro (II)– a pólvora negra quando finamente triturada é inflamável. Cristaliza no tipo estrutural de cloreto de sódio (rede cúbica de face centrada).
Apresenta propriedades predominantemente básicas. Insolúvel em água, facilmente solúvel em ácidos não oxidantes:
FeO + 2HCl = FeCl 2 + H 2 O.
Mostra propriedades restauradoras:
3FeO + 10HNO 3 = 3Fe(NO 3) 3 + NÃO + 5H 2 O.
É obtido pela decomposição do oxalato de ferro (II) em atmosfera de nitrogênio ou sem acesso de ar:
FeC 2 O 4 3H 2 O = FeO + 3H 2 O + CO 2 + CO
ou no processo de redução do óxido de ferro (III) com hidrogênio ou monóxido de carbono (II):
Fe 2 O 3 + CO = 2FeO + CO 2.
Hidróxido de ferro (II) Fe(OH) 2 quando precipitado recentemente, apresenta cor verde acinzentada, não se dissolve em água, decompõe-se em temperaturas acima de 150 ° C e escurece rapidamente devido à oxidação:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Apresenta propriedades anfotéricas suaves com predominância de básicas e reage facilmente com ácidos não oxidantes:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O.
Reage com soluções alcalinas concentradas quando aquecido para formar tetrahidroxoferrato (II):
Fe(OH)2 + 2NaOH = Na2.
Apresenta propriedades redutoras, ao interagir com ácido nítrico ou sulfúrico concentrado, formam-se sais de ferro (III):
2Fe (OH) 2 + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 6H 2 O.
É obtido pela reação de sais de ferro (II) com uma solução alcalina na ausência de oxigênio atmosférico:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4.
Sais de ferro (II). O ferro (II) forma sais com quase todos os ânions. Normalmente, os sais cristalizam na forma de hidratos cristalinos verdes: Fe(NO 3) 2 · 6H 2 O, FeSO 4 · 7H 2 O, FeBr 2 · 6H 2 O, (NH 4) 2 Fe (SO 4) 2 · 6H 2 O (Mohr's sal), etc
Postado em ref.rf
As soluções salinas têm uma cor verde pálida e, devido à hidrólise, um ambiente ácido:
Fe 2+ + H 2 O = FeOH + + H +.
Quando estão no ar, eles são lentamente oxidados pelo oxigênio dissolvido em sais de ferro (III):
4FeCl 2 + O 2 + 2H 2 O = 4FeOHCl 2.
Reação qualitativa no cátion Fe 2+ – interação com hexacianoferrato (III) de potássio (sal vermelho do sangue):
FeSO 4 + K 3 = KFe↓ + K 2 SO 4
Fe 2+ + K + + 3- = KFe↓
Como resultado da reação, forma-se um precipitado azul - ferro (III) - hexacianoferrato de potássio (II).
O estado de oxidação +3 é característico do ferro.
Óxido de ferro (III) Fe 2 O 3 – A substância marrom existe em três modificações polimórficas.
Apresenta propriedades anfotéricas suaves com predomínio das básicas. Reage facilmente com ácidos:
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O.
Não reage com soluções alcalinas, mas após a fusão forma ferritas:
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O.
Apresenta propriedades oxidantes e redutoras. Quando aquecido, é reduzido por hidrogênio ou monóxido de carbono (II), exibindo propriedades oxidantes:
Fe 2 O 3 + H 2 = 2FeO + H 2 O,
Fe 2 O 3 + CO = 2FeO + CO 2.
Fe 2 O 3 + 3KNO 3 + 4KOH = 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
A temperaturas superiores a 1400°C decompõe-se:
6Fe 2 O 3 = 4Fe 3 O 4 + O 2.
É obtido pela decomposição térmica do hidróxido de ferro (III):
2Fe(OH)3 = Fe2O3 + 3H2O
ou oxidação de pirita:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
Hidróxido de ferro (III) Fe(OH) 3 – substância cristalina ou amorfa de cor marrom. Assim como o óxido, apresenta propriedades anfotéricas fracamente expressas com predomínio das básicas. Reage facilmente com ácidos:
Fe(OH)3 + 3HCl = FeCl3 + 3H2O.
Reage com soluções concentradas de álcalis para formar hexahidroxoferratos (III):
Fe(OH)3 + 3NaOH = Na3,
quando fundido com álcalis ou reagentes alcalinos, forma ferritas:
Fe(OH)3 + NaOH = NaFeO2 + 2H2O,
2Fe(OH)3 + Na2CO3 = 2NaFeO2 + CO2 + 3H2O.
Na presença de agentes oxidantes fortes em ambiente alcalino, apresenta propriedades redutoras e é oxidado a derivados de ferro (VI):
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6NaBr + 8H2O.
Quando aquecido, decompõe-se:
Fe(OH)3 = FeO(OH) + H2O,
2FeO(OH) = Fe 2 O 3 + H 2 O.
É obtido pela reação de sais de ferro (III) com soluções alcalinas:
Fe 2 (SO 4) 3 + 6NaOH = 2Fe (OH) 3 + 3Na 2 SO 4.
Sais de ferro (III). O ferro (III) forma sais com quase muitos ânions. Normalmente os sais cristalizam na forma de hidratos cristalinos marrons: Fe(NO 3) 3 6H 2 O, FeCl 3 6H 2 O, NaFe(SO 4) 2 12H 2 O (alúmen de ferro), etc.
Postado em ref.rf
Em solução, os sais de ferro (III) são muito mais estáveis que os sais de ferro (II). As soluções salinas apresentam coloração marrom-amarelada e, devido à hidrólise, ambiente ácido:
Fe 3+ + H 2 O = FeOH 2+ + H +.
Os sais de ferro (III) são hidrolisados em em maior medida do que os sais de ferro (II), por esta razão os sais de ferro (III) e os ácidos fracos não podem ser isolados da solução; eles hidrolisam instantaneamente para formar hidróxido de ferro (III):
Fe 2 (SO 4) 3 + 3Na 2 CO 3 + 3H 2 O = 2Fe(OH) 3 + 3CO 2 + 3Na 2 SO 4.
Eles exibem todas as propriedades dos sais.
Eles têm propriedades predominantemente restauradoras:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl.
Reação qualitativa ao cátion Fe 3+ - interação com hexacianoferrato (II) de potássio (sal de sangue amarelo):
FeCl 3 + K 4 = KFe↓ + 3KCl
Fe 3+ + K + + 4- = KFe↓
Como resultado da reação, forma-se um precipitado azul - ferro (II) - hexacianoferrato de potássio (III).
Ao mesmo tempo, os íons Fe 3+ são determinados pela cor vermelho-sangue característica do tiocianato de ferro (III), que é formado como resultado da interação do sal de ferro (III) com o tiocianato de potássio ou amônio:
FeCl 3 + 3KCNS = Fe(SNC) 3 + 3KCl,
Fe 3+ + 3SNC - = Fe(SNC) 3 .
Compostos de ferro (III) – conceito e tipos. Classificação e características da categoria “Compostos de Ferro (III)” 2014, 2015.
Lição nº 5 Sistema de freio Tópico nº 8 Mecanismos de controle Sobre o projeto de equipamentos automotivos Realização de uma aula em grupo Plano - esboço Professor do ciclo POPON, Tenente Coronel S.A. "____"... .
Da posição I, gire calmamente a chave 180° para a posição II. Assim que você chegar à segunda posição, algumas luzes no painel de instrumentos definitivamente acenderão. Podem ser: uma luz de aviso de carga da bateria, uma luz de emergência da pressão do óleo,... .
Na era helenística, o desejo por pompa e grotesco na escultura intensificou-se. Algumas obras mostram paixões excessivas, enquanto outras mostram proximidade excessiva com a natureza. Nessa época, começaram a copiar diligentemente as estátuas de tempos anteriores; graças às cópias, hoje conhecemos muitas... .
Os primórdios da escultura gótica francesa foram estabelecidos em Saint-Denis. Os três portais da fachada ocidental da famosa igreja foram preenchidos com imagens escultóricas, nas quais pela primeira vez se manifestou o desejo de um programa iconográfico rigorosamente pensado, surgiu um desejo... Escultura russa do segundo andar. Século XVIII. Shubin, Kozlovsky, Gordeev, Prokofiev, Shchedrin e outros.
Etienne Maurice Falconet (1716-1791) na França e na Rússia (de 1766-1778). "The Threatening Cupid" (1757, Louvre, State Hermitage) e suas réplicas na Rússia. Monumento a Pedro I (1765-1782). A concepção e a natureza do monumento, a sua importância no conjunto da cidade. O papel da assistente de Falconet - Marie-Anne Collot (1748-1821) na criação... .