Какво може и какво не може по време на Рождественския пост?
През 2018 г. Рождественският пост ще започне на 28 ноември. През този период православните вярващи се подготвят да празнуват Коледа...
Химични свойства на желязотоНека да разгледаме примера на взаимодействието му с типичните неметали - сяра и кислород.
Смесете желязо и сяра, натрошени на прах в петриево блюдо. Нека нагреем стоманена игла за плетене в пламък и я докоснем до сместа от реактиви. Бурната реакция между желязото и сярата е придружена от освобождаване на топлина и светлинна енергия. Твърдият продукт от взаимодействието на тези вещества, железен (II) сулфид, е черен. За разлика от желязото, не се привлича от магнит.
Желязото реагира със сярата, за да образува железен (II) сулфид. Нека съставим уравнението на реакцията:
Реакцията на желязото с кислорода също изисква предварително нагряване. Изсипете кварцов пясък в съд с дебели стени. Нека нагреем сноп много тънка желязна тел - така наречената желязна вълна - в пламъка на горелка. Поставете горещата тел в съд, съдържащ кислород. Желязото гори с ослепителен пламък, разпръсквайки искри - горещи частици от желязна скала Fe 3 O 4.
Същата реакция възниква и във въздуха, когато стоманата става много гореща от триене по време на обработка.
Когато желязото гори в кислород или във въздух, се образува железен котлен камък:
3Fe + 2O 2 = Fe 3 O 4, Материал от сайта
или 3Fe + 2O 2 = FeO. Fe 2 O 3 .
Железният оксид е съединение, в което има желязо различни значениявалентност.
Преминаването на двете реакции на връзката е придружено от освобождаване на топлинна и светлинна енергия.
На тази страница има материали по следните теми:
Въпроси относно този материал:
Цели на урока:
Оборудване:желязо (прах, карфица, плоча), сяра, кислородна колба, солна киселина, железен (II) сулфат, железен (III) хлорид, натриев хидроксид, червени и жълти кръвни соли.
ПО ВРЕМЕ НА ЗАНЯТИЯТА
I. Организационен момент
II. Проверка на домашните
III. Учене на нов материал
1. Въведение на учителя.
– Значението на желязото в живота, ролята му в историята на цивилизацията. Един от най-често срещаните метали в земната корае желязо. Започва да се използва много по-късно от други метали (мед, злато, цинк, олово, калай), което най-вероятно се дължи на ниското сходство на желязната руда с метала. За примитивните хора беше много трудно да разберат, че от руда може да се получи метал, който може успешно да се използва в производството на различни предмети; това се дължи на липсата на инструменти и необходимите устройства за организиране на такъв процес. Мина доста време, преди човекът да се научи да извлича желязо от руда и да прави стомана и чугун от него.
В момента железните руди са необходима суровина за черната металургия, онези минерали, без които нито една развита индустриална страна не може. Годишното световно производство на желязна руда е приблизително 350 000 000 тона. Те се използват за топене на желязо (съдържание на въглерод 0,2-0,4%), чугун (2,5-4% въглерод), стомана (2,5-1,5% въглерод).Стоманата има най-широко приложение в промишлеността от желязото и чугуна, което е защо има по-голямо търсене на топенето му.
За топене на чугун от желязна руда се използват доменни пещи, работещи с въглища или кокс; стоманата и желязото се топят от чугун в реверберационни пещи с открита пещ, конвертори на Бесемер или метода на Томас.
Черните метали и техните сплави са от голямо значение за живота и развитието на човешкото общество. От желязо се изработват всякакви предмети за бита и потреблението. За изграждане на кораби, самолети, железопътни линии, автомобили, мостове, железници, различни сгради, оборудване и други неща, се използват стотици милиони тонове стомана и чугун. Няма отрасъл на селското стопанство и индустрията, в който да не се използват желязото и различните му сплави.
Малкото минерали, които обикновено се срещат в природата и съдържат желязо, са желязната руда. Такива минерали включват: кафява желязна руда, хематит, магнетит и други, които образуват големи находища и заемат огромни площи.
Химическата връзка на магнетита или магнитната желязна руда, която има желязо-черен цвят и уникално свойство - магнетизъм, е съединение, състоящо се от железен оксид и железен оксид. IN естествена средаможе да се намери както под формата на гранулирани или твърди маси, така и под формата на добре оформени кристали. Желязната руда е най-богата на съдържанието на метално желязо магнетит (до 72%).
Най-големите находища на магнетитни руди в нашата страна се намират в Урал, в планините Висока, Благодат, Магнитна, в някои райони на Сибир - басейна на река Ангара, планинска Шория, на територията на Колския полуостров.
2. Работа с класа. Характеристики на желязото като химичен елемент
а) Позиция в периодичната таблица:
Упражнение 1.Определете позицията на желязото в периодичната таблица?
Отговор:Желязото се намира в 4-ти голям период, четен ред, 8-ма група, второстепенна група.
б) структура на атома:
Задача 2.Начертайте състава и структурата на железния атом, електронна формула и клетки.
Отговор: Fe +3 2) 8) 14) 2) метал
p = 26
e = 26
n = (56 – 26) = 301s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Въпрос.Върху кои слоеве желязо са разположени валентните електрони? Защо?
Отговор.Валентните електрони са разположени на последния и предпоследния слой, тъй като това е елемент от вторичната подгрупа.
Желязото се класифицира като d-елемент, част е от триадата елементи – метали (Fe-Co-Ni);
в) редокс свойства на желязото:
Въпрос.Какво е желязото - окислител или редуктор? Какви степени на окисление и валентност проявява?
Отговор:
Fe 0 – 2e = Fe +3) редуциращ агент
Fe 0 – 3e = Fe +3
с.о.+ 2,+ 3; валентност = II и III, валентност 7 – не се показва;
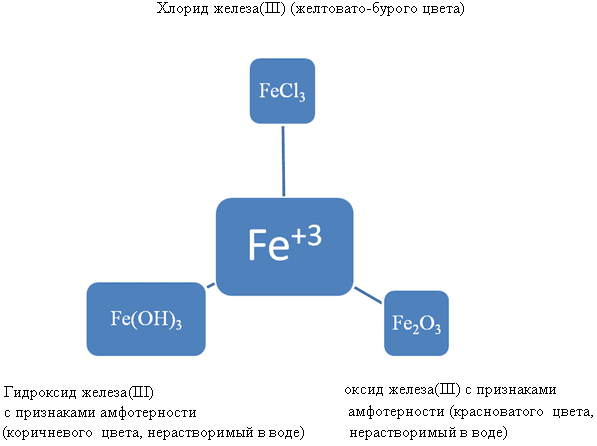
г) железни съединения:
FeO – основен оксид
Fe(OH) 2 – неразтворима основа
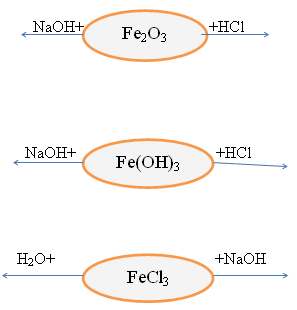
Fe 2 O 3 – оксид с признаци на амфотерност
Fe(OH) 3 – основа с признаци на амфотерност
Летливите водородни съединения не са.
г) пребиваване сред природата.
Желязото е вторият най-разпространен метал в природата (след алуминия).В свободно състояние желязото се среща само в метеоритите.Най-важните природни съединения:
FeO*3HO – кафява желязна руда,
FeO – червена желязна руда,
FeO (FeO*FeO) – магнитна желязна руда,
FeS – железен пирит (пирит)
Съединенията на желязото се намират в живите организми.
3. Характеристика на простото вещество желязо
а) молекулярна структура, тип връзка, тип кристална решетка; (независимо)
б) физични свойства на желязото
Желязото е сребристосив метал, има голяма ковкост, пластичност и здравина магнитни свойства. Плътността на желязото е 7,87 g / cm 3, точката на топене е 1539 t o C.
в) химични свойства на желязото:
Атомите на желязото отдават електрони в реакциите и проявяват степени на окисление + 2, + 3 и понякога + 6.
В реакциите желязото е редуциращ агент. Но при обикновени температури той не взаимодейства дори с най-активните окислители (халогени, кислород, сяра), но при нагряване става активен и реагира с тях:
2Fe +3Cl 2 = 2FeCl 3 Железен(III) хлорид
3Fe + 2O 2 = Fe 2 O 3 (FeO*Fe O) Железен(III) оксид
Fe +S = FeS Железен(II) сулфид
При много висока температуражелязото реагира с въглерод, силиций и фосфор.
3Fe + C = Fe 3 C Железен карбид (цементит)
3Fe + Si = Fe 3 Si Железен силицид
3Fe + 2P = Fe 3 P 2 Железен фосфид
Желязото реагира със сложни вещества.
Във влажен въздух желязото бързо се подкислява (корозира):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3
Fe(OH) 3 ––> FeOOH + H 2 O
Ръжда
Желязото е в средата на електрохимичните напрежения от метали, следователно е метал средна активност.Редукционната способност на желязото е по-малка от тази на алкалните, алкалоземните метали и алуминия. Само при високи температури горещото желязо реагира с вода:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2
Желязото реагира с разредена сяра и солни киселини, измествайки водорода от тях:
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
Fe 0 + 2H + = Fe 2+ + H 2 0
При обикновени температури желязото не взаимодейства с концентрирана сярна киселина, тъй като се пасивира от нея.При нагряване концентрираната сярна киселина окислява желязото до железен (III) сулфат:
2Fe + 6H 2 SO 4 = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Разредената азотна киселина окислява желязото до железен (III) нитрат:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O
Концентрираната азотна киселина пасивира желязото.
От солните разтвори желязото измества металите, които са разположени вдясно от него в електрохимичната серия на напрежение:
Fe + CuSO 4 = FeSO 4 + Cu,
г) използване на желязо (самостоятелно)
д) получаване (заедно с ученици)
В промишлеността желязото се получава чрез редуцирането му от железни руди с въглерод (кокс) и въглероден оксид (II) в доменни пещи.
Химическият процес на доменната пещ е както следва:
C + O = CO
CO + C = 2CO
3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
Fe 3 O 4 + CO = 3FeO + CO 2
FeO + CO = Fe + CO 2
4. Съединения на желязото
Химични свойства на тези съединения.

Допълнение.Съединенията на желязото (II) са нестабилни, те могат да се окислят и да се превърнат в съединения на желязото (III).
Fe +2 Cl 2 + Cl 2 = Fe +3 Cl 3 образува редокс сграда
Fe +2 (OH) + H 2 O + O 2 = Fe +3 (OH) 3 схеми, изравнете.
Химични свойства на тези съединения
Също така, качествена реакция към Fe +2 е реакцията на соли на желязо (II) с вещество, наречено червена кръвна сол K3 - това е сложно съединение.
3FeCl + 2K 3 = Fe 3,"de":["HY7CqWc6WfE"],"es":["zhomCMDQurk","cFsKQvX-sH8","o2GN1FUPJH8"],"pt":["uIEIrciTwOc","0AyoZ_UU2yY" ],"fr":["31nvESQbbG8","1FmdeA4K5gg"],"ro":["6HNFpOmTS2c","YAlG-FBbUWc","YAlG-FBbUWc"])