Katedralja e Shpalljes së Kremlinit të Moskës
Një nga kishat më të vjetra në Kremlinin e Moskës qëndron në buzë të Sheshit të Katedrales në buzë të Kodrës Borovitsky. Shumë shekuj...
Vetitë kimike të hekurit Le të shohim shembullin e ndërveprimit të tij me jometalet tipike - squfurin dhe oksigjenin.
Përzieni hekurin dhe squfurin e grimcuar në pluhur në një enë Petri. Le të ngrohim një gjilpërë thurjeje çeliku në një flakë dhe ta prekim atë në përzierjen e reagentëve. Një reagim i dhunshëm midis hekurit dhe squfurit shoqërohet me çlirimin e energjisë së nxehtësisë dhe dritës. Produkti i ngurtë i bashkëveprimit të këtyre substancave, sulfuri i hekurit (II), është i zi. Ndryshe nga hekuri, ai nuk tërhiqet nga një magnet.
Hekuri reagon me squfurin për të formuar sulfid hekuri (II). Le të krijojmë ekuacionin e reagimit:
Reagimi i hekurit me oksigjen kërkon gjithashtu ngrohje paraprake. Derdhni rërë kuarci në një enë me mure të trasha. Le të ngrohim një tufë me tela hekuri shumë të hollë - të ashtuquajturin lesh hekuri - në flakën e një djegësi. Vendoseni telin e nxehtë në një enë që përmban oksigjen. Hekuri digjet me një flakë verbuese, duke shpërndarë shkëndija - grimca të nxehta të shkallës së hekurit Fe 3 O 4.
I njëjti reagim ndodh edhe në ajër, kur çeliku nxehet shumë nga fërkimi gjatë përpunimit.
Kur hekuri digjet në oksigjen ose në ajër, formohet peshore hekuri:
3Fe + 2O 2 = Fe 3 O 4, Materiali nga faqja
ose 3Fe + 2O 2 = FeO. Fe 2 O 3 .
Oksidi i hekurit është një përbërje në të cilën hekuri ka kuptime të ndryshme valencë.
Kalimi i të dy reaksioneve të lidhjes shoqërohet me çlirimin e energjisë termike dhe të dritës.
Në këtë faqe ka materiale për temat e mëposhtme:
Pyetje rreth këtij materiali:
Objektivat e mësimit:
Pajisjet: hekur (pluhur, gjilpërë, pjatë), squfur, balonë oksigjeni, acid klorhidrik, sulfat hekuri (II), klorur hekuri (III), hidroksid natriumi, kripëra gjaku të kuqe dhe të verdha.
GJATË KLASËVE
I. Momenti organizativ
II. Kontrollimi i detyrave të shtëpisë
III. Mësimi i materialit të ri
1. Prezantimi i mësuesit.
– Rëndësia e hekurit në jetë, roli i tij në historinë e qytetërimit. Një nga metalet më të zakonshme në kores së tokësështë hekuri. Filloi të përdoret shumë më vonë se metalet e tjera (bakri, ari, zinku, plumbi, kallaji), gjë që ka shumë të ngjarë për shkak të ngjashmërisë së ulët të mineralit të hekurit me metalin. Ishte shumë e vështirë për njerëzit primitivë të kuptonin se metali mund të përftohej nga xeherori, i cili mund të përdorej me sukses në prodhimin e objekteve të ndryshme, kjo për shkak të mungesës së mjeteve dhe pajisjeve të nevojshme për organizimin e një procesi të tillë. Kaloi shumë kohë para se njeriu të mësonte të nxirrte hekur nga xeherori dhe të bënte çelik dhe gize prej tij.
Për momentin, xehet e hekurit janë një lëndë e parë e nevojshme për metalurgjinë e zezë, ato minerale pa të cilat asnjë vend industrial i zhvilluar nuk mund të bëjë. Prodhimi vjetor botëror i mineralit të hekurit është afërsisht 350,000,000 ton. Përdoren për shkrirjen e hekurit (përmbajtja e karbonit 0,2-0,4%), gize (2,5-4% karbon), çeliku (2,5-1,5% karbon), çeliku ka përdorimin më të gjerë në industri sesa hekuri dhe gize, që është pse ka kërkesa më të mëdha për shkrirjen e tij.
Për shkrirjen e gizës nga xeherorët e hekurit, përdoren furrat shpërthyese që funksionojnë me qymyr ose çelik dhe hekuri shkrihet nga gize në furrat e hapura me reverberator, konvertuesit Bessemer ose metodën Thomas;
Metalet me ngjyra dhe lidhjet e tyre kanë një rëndësi të madhe në jetën dhe zhvillimin e shoqërisë njerëzore. Të gjitha llojet e sendeve shtëpiake dhe të konsumit janë prej hekuri. Për ndërtimin e anijeve, avionëve, hekurudhave, makinave, urave, hekurudhat, ndërtesa të ndryshme, pajisje dhe gjëra të tjera, përdoren qindra miliona tonë çelik dhe gize. Nuk ka asnjë degë të bujqësisë dhe industrisë në të cilën nuk përdoret hekuri dhe lidhjet e tij të ndryshme.
Mineralet e pakta që gjenden zakonisht në natyrë që përmbajnë hekur janë minerali i hekurit. Të tilla minerale përfshijnë: mineral hekuri të murrmë, hematit, magnetit dhe të tjerë që formojnë depozita të mëdha dhe zënë zona të gjera.
Lidhja kimike e magnetitit ose mineralit magnetik të hekurit, i cili ka një ngjyrë hekuri të zezë dhe një veti unike - magnetizëm, është një përbërje e përbërë nga oksid hekuri dhe oksid hekuri. NË mjedisi natyror mund të gjendet si në formë masash kokrrizore ose të ngurta, ashtu edhe në formë kristalesh të formuara mirë. Minerali i hekurit është më i pasur në përmbajtjen e hekurit metalik të magnetitit (deri në 72%).
Depozitat më të mëdha të xeheve të magnetitit në vendin tonë ndodhen në Urale, në malet Vysokaya, Blagodat, Magnitnaya, në disa zona të Siberisë - pellgu i lumit Angara, mali Shoria, në territorin e Gadishullit Kola.
2. Punoni me klasën. Karakteristikat e hekurit si element kimik
a) Pozicioni në tabelë periodike:
Ushtrimi 1. Përcaktoni pozicionin e hekurit në tabelën periodike?
Përgjigje: Hekuri ndodhet në periudhën e 4-të madhore, rresht çift, grupi i 8-të, grupi minor.
b) struktura e atomit:
Detyra 2. Vizatoni përbërjen dhe strukturën e atomit të hekurit, formulën elektronike dhe qelizat.
Përgjigje: Fe +3 2) 8) 14) 2) metal
p = 26
e = 26
n = (56 – 26) = 301s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Pyetje. Në cilat shtresa të hekurit ndodhen elektronet valente? Pse?
Përgjigju. Elektronet e valencës janë të vendosura në shtresat e fundit dhe të parafundit, pasi ky është një element i nëngrupit dytësor.
Hekuri klasifikohet si d-element është pjesë e treshes së elementeve - metaleve (Fe-Co-Ni);
c) vetitë redoks të hekurit:
Pyetje.Çfarë është hekuri - një agjent oksidues apo një agjent reduktues? Çfarë gjendjesh oksidimi dhe valence shfaq?
Përgjigje:
Fe 0 – 2e = Fe +3) agjent reduktues
Fe 0 – 3e = Fe +3
s.o.+ 2,+ 3; valenca = II dhe III, valenca 7 – nuk tregon;
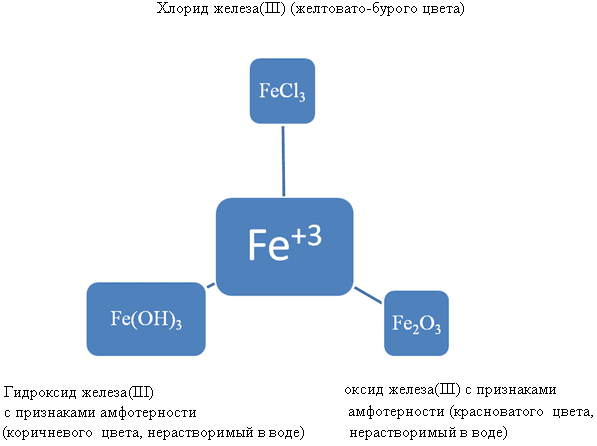
d) komponimet e hekurit:
FeO – oksid bazë
Fe(OH) 2 – bazë e patretshme
Fe 2 O 3 – oksid me shenja amfoteriteti
Fe(OH) 3 – një bazë me shenja amfoteriteti
Komponimet e avullueshme të hidrogjenit nuk janë.
d) të qenit në natyrë.
Hekuri është metali i dytë më i bollshëm në natyrë (pas aluminit, në gjendje të lirë, hekuri gjendet vetëm në meteoritët).
FeO*3HO – mineral hekuri kafe,
FeO – mineral hekuri i kuq,
FeO (FeO*FeO) – mineral hekuri magnetik,
FeS – pirit hekuri (pirit)
Komponimet e hekurit gjenden në organizmat e gjallë.
3. Karakteristikat e substancës së thjeshtë hekur
a) struktura molekulare, lloji i lidhjes, lloji i rrjetës kristalore (i pavarur);
b) vetitë fizike të hekurit
Hekuri është një metal gri argjendi, ka lakueshmëri të madhe, duktilitet dhe të fortë vetitë magnetike. Dendësia e hekurit është 7,87 g/cm 3, pika e shkrirjes është 1539 t o C.
c) vetitë kimike të hekurit:
Atomet e hekurit dhurojnë elektrone në reaksione dhe shfaqin gjendje oksidimi prej + 2, + 3 dhe ndonjëherë + 6.
Në reaksione, hekuri është një agjent reduktues. Sidoqoftë, në temperatura të zakonshme nuk ndërvepron as me agjentët oksidues më aktivë (halogjene, oksigjen, squfur), por kur nxehet bëhet aktiv dhe reagon me to:
2Fe +3Cl 2 = 2FeCl 3 Klorur hekuri (III)
3Fe + 2O 2 = Fe 2 O 3 (FeO*Fe O) Oksid hekuri (III)
Fe +S = FeS Sulfidi i hekurit(II).
Në shumë temperaturë të lartë hekuri reagon me karbonin, silicin dhe fosforin.
3Fe + C = Fe 3 C Karbit hekuri (çimentit)
3Fe + Si = Fe 3 Si Silicid hekuri
3Fe + 2P = Fe 3 P 2 Fosfidi i hekurit
Hekuri reagon me substanca komplekse.
Në ajër të lagësht, hekuri acidifikohet shpejt (gërryhet):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3
Fe(OH) 3 ––> FeOOH + H 2 O
Ndryshk
Hekuri është në mes të serisë së tensionit elektrokimik të metaleve, prandaj është një metal aktivitet mesatar. Aftësia reduktuese e hekurit është më e vogël se ajo e alkalit, metaleve alkaline tokësore dhe aluminit. Vetëm në temperatura të larta hekuri i nxehtë reagon me ujin:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2
Hekuri reagon me squfurin e holluar dhe acidet klorhidrike, duke zhvendosur hidrogjenin prej tyre:
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
Fe 0 + 2H + = Fe 2+ + H 2 0
Në temperatura të zakonshme, hekuri nuk ndërvepron me acidin sulfurik të përqendruar, pasi pasivohet prej tij, acidi sulfurik i koncentruar oksidon hekurin në sulfat hekuri (III).
2Fe + 6H 2 SO 4 = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Acidi nitrik i holluar oksidon hekurin në nitrat hekuri (III):
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O
Acidi nitrik i koncentruar pasivizon hekurin.
Nga solucionet e kripës, hekuri zhvendos metalet që ndodhen në të djathtë të tij në serinë e tensionit elektrokimik:
Fe + CuSO 4 = FeSO 4 + Cu,
d) përdorimi i hekurit (vetëm)
e) marrja (së bashku me studentët)
Në industri, hekuri fitohet duke e reduktuar atë nga mineralet e hekurit me karbon (koks) dhe monoksid karboni (II) në furrat e zjarrit.
Kimia e procesit të furrës së shpërthimit është si më poshtë:
C + O = CO
CO + C = 2 CO
3Fe 2 O 3 + CO = 2 Fe 3 O 4 + CO 2
Fe 3 O 4 + CO = 3 FeO + CO 2
FeO + CO = Fe + CO 2
4. Përbërjet e hekurit
Vetitë kimike të këtyre përbërjeve.

Shtim. Komponimet e hekurit (II) janë të paqëndrueshme, ato mund të oksidohen dhe të kthehen në komponime hekuri (III)
Fe +2 Cl 2 + Cl 2 = Fe +3 Cl 3 përbëjnë shtëpinë redoks
Fe +2 (OH) + H 2 O + O 2 = Fe +3 (OH) 3 skemat, barazohen.
Vetitë kimike të këtyre përbërjeve
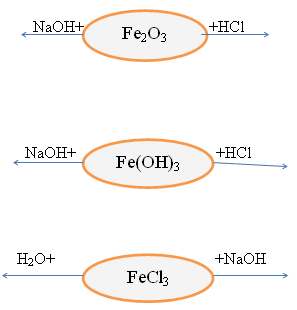
Gjithashtu, një reagim cilësor ndaj Fe +2 është reagimi i kripërave të hekurit (II) me një substancë të quajtur kripë e kuqe e gjakut K3 - kjo është një përbërje komplekse.
3FeCl + 2K 3 = Fe 3,"de":["HY7CqWc6WfE"],"es":["zhomCMDQurk","cFsKQvX-sH8","o2GN1FUPJH8"],"pt":["uIEIrciTwOc","0AyoYU" ],"fr":["31nvESQbbG8","1FmdeA4K5gg"],"ro":["6HNFpOmTS2c","YAlG-FBbUWc","YAlG-FBbUWc"])