20.04.2019
Порушення обміну амінокислот. Спадкові порушення обміну амінокислот
Гіпераміноацидурія
. Про гіпераміноацидурії говорять у тому випадку, коли виведення однієї або кількох амінокислот із сечею перевищує фізіологічні значення.
Залежно від походження можна виділити: 1. метаболічні або преренальні та 2. ренальні аміноацидурії.
При метаболічних аміноацидуріях однієї або кількох амінокислот утворюється більше, ніж у нормі, або метаболізується менша їх кількість. Надлишок перевищує реабсорбційну здатність канальців, тому амінокислоти «переливаються через край», виділяються із сечею. У цих випадках поряд із підвищеною аміноацидурією виявляється підвищена концентрація відповідних амінокислот у крові.
З симптоматичними формами метаболічних аміноацидурій можна зустрітися при важких поразкахпечінки.
Однак у більшості випадків метаболічні аміноацидурії являють собою спадкові ензімопатії: проміжний обмін будь-якої амінокислоти порушується внаслідок нестачі певного ензиму. Продукти обміну речовин, що утворилися до ензиматичного блоку, накопичуються в крові та у великій кількості виділяються із сечею.
При нирковій аміноацидурії амінокислоти синтезуються в нормальній кількості, проте внаслідок вродженого або набутого пошкодження ниркових канальців вони у великій кількості виділяються із сечею. Ці аномалії більш докладно описані на чолі про захворювання нирок. Тут буде приділено увагу лише вродженим метаболічним аміноацидуріям.
Фенілкетонурія. Фенілпіровіноградна олігофренія (хвороба Феллінга). Ензімопатія, успадкована за аутосомно-рецесивним типом. Її біохімічною сутністю є неможливість перетворення фенілаланіну на тирозин внаслідок відсутності ферменту фенілаланін-оксидази. Клінічні проявицієї аномалії пов'язані з вираженим ушкодженням мозку, що супроводжується розумовою відсталістю. Це нерідке захворювання- одна з найбільш частих причинолігофренії. Серед населення зустрічається із частотою 1:10 000-1: 20 000.
Патогенез. Через відсутність ферменту, що бере участь в обміні фенілаланіну – фенілаланін-оксидази, у крові накопичується фенілаланін і продукт його метаболізму – фенілпіровіноградна кислота. Накопичення цих речовин є причиною провідного клінічного симптому – ураження мозку, що викликається, мабуть, гальмуючим впливом цих метаболітів на інші ензиматичні процеси в мозку. Крім того, у формуванні хвороби певну роль відіграє також порушення нормального синтезу тирозину, який є основним матеріалом для виробництва адреналіну, норадреналіну та дийодтирозину.
клінічна картина. Провідною ознакою фенілкетонурії є олігофренія, що проявляється вже в ранньому грудному віці і швидко прогресує. Нерідко зустрічається гіпертонія м'язів, у частині випадків спостерігаються епілептиформні судоми.
Серед інших змін, пов'язаних із дефектом обміну речовин, слід згадати недостатню пігментацію хворих. Багато з них блакитноокі, мають світлу шкіру і біляве волосся. Часто зустрічаються брахіцефалія та гіпертейлоризм. Артеріальний тискзазвичай низька. Пот хворих має неприємний («мишачий») запах.
Діагноз. У зв'язку з можливістю лікування захворювання велике значеннямає раннє розпізнавання носіїв аномалії. Фенілаланін та продукти його обміну можна виявити в крові та сечі. Концентрація фенілаланіну в крові у багато разів перевищує верхню межу норми (1,5 мг%). У сечі за допомогою проби Феллінга можна якісно показати присутність фенілпіровиноградної кислоти: при додаванні розчину хлориду заліза сеча набуває темно-зеленого кольору.
Однак ця проба стає позитивною лише у віці 3-4 тижнів та, крім того, не є специфічною. Точніші результати вже наприкінці першого тижня дає проба Гутрі: мікробіологічний метод, заснований на впливі, який надає фенілаланін на зростання сінної палички. Безумовно, цей метод є найбільш прийнятним для обстеження популяції немовлят. Його недоліком є необхідність взяття крові, проведення якого в широких масштабах поки що важко. Доки цей аналіз не стане загальним, необхідно в 3-4-тижневому віці проводити ферохлоридну пробу і в підозрілих випадках підтвердити діагноз шляхом дослідження спектра амінокислот крові та сечі методом хроматографії на папері. При обтяженій спадковості аналіз крові слід проводити вже на першому тижні життя.
Лікування. При рано розпочатій терапії, по можливості вже в період новонародженості, можна досягти успіху шляхом зниження до мінімуму вмісту фенілаланіну в дієті. Однак застосування казеїнгідролізату, який становить основу дієти, забезпечуючи обмеження фенілаланіну, важко і дорого. Наразі запропоновано спеціальні препаратидля лікування фенілкетонурії – берлофен, лофеналак, мінафен, гіпофенат, – які задовільно переносяться хворими. При лікуванні, розпочатому в пізньому грудному віці, можна досягти лише припинення подальшого прогресуванняідіотії.
Алкаптонурія. Захворювання характеризується темно-коричневим забарвленням сечі, що виникає при стоянні на повітрі. Спадкова ензімопатія, у хворих відсутня фермент гомогентизиназу. Гомогентизиновая кислота, що виділяється у більшій кількості, на повітрі окислюється, набуваючи коричневий колір. Пелюшки та спідня білизна дитини також забарвлюються, що полегшує постановку діагнозу.
Крім описаної вище особливості сечі, при цій аномалії є тільки два інших симптоми: що з'являється у більш пізньому віціартропатія і синювате забарвлення хрящів, що легко виявляється на вушній раковині. Лікування немає.
Альбінізмтакож є спадковою аномалією обміну ароматичних амінокислот. При цьому відсутній ензим тирозиназу, який каталізує перетворення тирозину на ДОФА - діоксифенілаланіц. Оскільки ДОФА - основа для синтезу меланіну, то носії аномалії світлошкірі, світловолосі люди, у яких через позбавлену пігментації райдужну оболонку просвічує червона судинна мережа.
Альбінізм невиліковний. Хворим слід уникати прямого сонячного світла.
Хвороба кленового сиропу. Рецесивно успадкована рідкісна ензімопатія. При цьому захворюванні відсутня специфічна декарбоксилаза, яка необхідна для метаболізму трьох важливих амінокислот: валіну, лейцину та ізолейцину. Ці амінокислоти та їх метаболіти накопичуються в крові та у значних кількостях виділяються із сечею. Продукти обміну надають сечі особливого запаху, що нагадує запах сиропу, приготованого з кленового соку.
Основним проявом захворювання є ураження мозку, що супроводжується судомами, що розвивається вже в перші тижні життя і закінчується смертю в ранньому грудному віці.
При постановці діагнозу має значення проба Феллінга, бо якщо вона позитивна, то вказує напрямок подальших досліджень; точний діагноз встановлюється за допомогою дослідження амінокислот крові та сечі методом хроматографії на папері.
Для лікуванняробляться спроби досягти поліпшення обміну з допомогою синтетичної дієти.
Хвороба Хертнапа. Дуже рідкісне спадкове захворювання, яке супроводжується нирковою гіпераміноацидурією. Велика кількість індикану, що виявляється у сечі, вказує на порушення обміну триптофану. Клінічно характеризується мозочковою атаксієюта змінами шкіри, що нагадують пелагру.
Оксалоз. Рідкісне спадкове захворювання. Внаслідок ензиматичного блоку в обміні глікокола утворюється велика кількість щавлевої кислоти, яка накопичується в організмі та виділяється із сечею.
Клінічно провідними ознаками є болі внаслідок каменеутворення у нирках, кров та гній у сечі. Крім нирок кристали оксалату кальцію відкладаються в мозку, селезінці, лімфатичних вузлах та кістковому мозку.
Діагнозґрунтується на виявленні гіпероксалурії та кристалів оксалату н кістковому мозку та лімфатичних вузлах.
У лікуванні- поряд з симптоматичною терапією - перспективним є постійний прийом бензоату натрію, який утворює разом з глікоколом гіпопурову кислоту і зменшує продукцію щавлевої кислоти.
Цістіноз. Спадкове, аутосомно-рецесивне захворювання, в основі якого лежить накопичення кристалів цистину в ретикулоендотелії та окремих органахі що розвивається у зв'язку з цим важка нефропатія.
Патогенеззахворювання недостатньо зрозумілий, мабуть, йдеться про метаболічний блок у катаболізмі цистину.
Клінічна симптоматика. До початкових змін належить збільшення розмірів селезінки та печінки, що розвивається в перші місяці життя. Вирішальна доля хворого нефропатія проявляється у другому півріччі життя. З'являються ознаки, що вказують на початкові ушкодження канальцеві: гіпераміноацидурія, глюкозурія, протеїнурія. Пізніше становище обтяжується поліурією, нирковим канальцевим ацидозом, а також гіпокаліємією та гіпофосфатемією ниркового походження. Поліурія викликає ексікоз та гіпертермію, фосфат-діабет стає причиною рахіту та карликового росту, дефіцит калію проявляється паралічами. У кінцевій стадії захворювання до канальцевої недостатності приєднується клубочкова недостатність, розвивається уремія.
Діагноз. Канальцева недостатність, глюкозурія, ацидоз, гіпераміноацидурія, гіперфосфатурія, що супроводжуються остеопатією та карликовим зростанням, у розгорнутій фазі захворювання дають у сукупності характерну картину. Ці зрушення відповідають картині синдрому Де Тоні-Дебре-Фанконі, який, однак, може мати інше походження.
При диференціальній діагностиці вирішальне значення має виявлення кристалів цистину в рогівці з допомогою щілинної лампи чи біоптичному препараті лімфатичних залоз.
Для лікуванняпризначають дієту з обмеженням метіоніну та цистину. З метою симптоматичної терапії застосовуються високі дозивітаміну D, введення лужних розчиніві компенсація нестачі калію, збільшена кількість води в раціоні дитини та, нарешті, пеніциламін.
Прогнозпоганий.
Гомоцистінурія. Клінічна симптоматика аномалії характеризується олігофренією різного ступеня, ектопією кришталиків, звертають на себе увагу біляве волосся. У крові підвищено вміст метіоніну та гомоцистину, за допомогою спеціальних методіву сечі виявляють гомоцистин.
Лікування- Бідна метіоніном дієта, проте вона не дуже ефективна.
Жіночий журнал www.
Це найчисленніша група спадкових хвороб обміну речовин. Майже всі вони успадковуються за аутосомно-рецесивним типом. Причина захворювань – недостатність того чи іншого ферменту, відповідального за синтез амінокислот. Хвороби супроводжуються блюванням та зневодненням організму, летаргічним станом або збудженням та судомами. У пізньому віці проявляється згасання розумового та фізичного розвитку.
До спадкових хвороб з порушеним амінокислотним обміном відноситься фенілкетонурія, альбінізм та ін.
Фенілкетонурія (ФКУ)
вперше була описана А. Фелінгом у 1934 р. У хворих порушено перетворення амінокислоти фенілаланіну на тирозин через різке зниження активності ферменту фенілаланінгідроксилази. В результаті вміст фенілаланіну в крові та сечі хворих значно зростає. Далі фенілаланін перетворюється на фенілпіровіноградну кислоту, яка є нейротропною отрутою і порушує формування мієлінової оболонки навколо аксонів центральної нервової системи.
Фенілкетонурія зустрічається в середньому у світовому масштабі з частотою 1 на 1000 новонароджених. Однак за цим показником є значні відмінності між популяціями: 1:2600 у Туреччині, 1:4500 у Ірландії, 1:30000 у Швеції, 1:119000 у Японії. Частота гетерозиготного носія у більшості європейських популяцій становить 1:100.
Локус (фенілгідроксилази) розташований у довгому плечі 12-ї хромосоми. В даний час для більшості сімей можлива молекулярно-генетична діагностика та виявлення гетерозиготного носія. Хвороба успадковується за аутосомно-домінантним типом. Відомо кілька форм фенілкетонурії, які різняться за тяжкістю перебігу хвороби. Це з наявністю 4-х алелей гена та його комбінаціями.
Дитина з фенілкетонурією народжується здоровою, але в перші ж тижні у зв'язку з надходженням фенілаланіну в організм з молоком матері розвивається підвищена збудливість, судомний синдром, схильність до дерматитів, сеча і піт хворих мають характерний «мишачий» запах, але головними симптомами ФКУ є судомні напади та олігофренія.
Більшість хворих - блондини зі світлою шкірою та блакитними очимащо визначається недостатнім синтезом пігменту меланіну. Діагноз захворювання встановлюється на підставі клінічних даних та результатів біохімічного аналізу сечі (на фенілпіровіноградну кислоту) та крові (на фенілаланін). З цією метою кілька крапель крові на фільтрувальному папері піддають хроматографії та визначають вміст фенілаланіну. Іноді використовують пробу Феллінга - в 2,5 мл свіжої сечі дитини додають 10 крапель 5% розчину трихлористого заліза та оцтової кислоти. Поява синьо-зеленого фарбування свідчить про наявність захворювання.
Метод лікування фенілкетонурії в даний час добре розроблений. Він полягає у призначенні хворому дієти (овочі, фрукти, варення, мед) та спеціально оброблених гідролізатів білків з низьким змістомфенілаланіну (лофелак, кетоніл, мінафен та ін). В даний час розроблено методи допологової діагностики. Рання діагностика та профілактичне лікування попереджають розвиток хвороби.
Альбінізм (око-шкірний)
описаний 1959 р. Хвороба зумовлена відсутністю синтезу ферменту тирозинази. Для неї характерна знебарвлення шкіри, волосся, очей, незалежно від раси та віку. Шкіра хворих на рожево-червона, зовсім не засмагає. Має схильність до злоякісних новоутворень. Волосся біле або жовтувате. Райдужка сіро-блакитного кольору, але може бути і рожева через відображення світла від очного дна. Хворим властива сильна світлобоязнь, їх зір знижений і не покращується з віком.
Альбінізм зустрічається з частотою 1 на 39.000, успадковується за аутосомно-рецесивним типом. Ген локалізовано на довгому плечі 11-ї хромосоми.
Спадкові захворювання,пов'язані з порушенням
обміну вуглеводів
Відомо, що вуглеводи входять до складу низки біологічно-активних речовин - гормонів, ферментів, мукополісахаридів, що виконують енергетичну та структурну функції. Внаслідок порушення вуглеводного обміну розвивається глікогенова хвороба, галактоземія та ін.
Глікогенова хвороба
пов'язана з порушенням синтезу та розкладання глікогену - тваринного крохмалю. Глікоген утворюється із глюкози при голодуванні; в нормі він знову перетворюється на глюкозу та засвоюється організмом. При порушенні цих процесів у людини розвиваються тяжкі захворювання. різні типиглікогенозу. До них відносяться хвороба Гірке, хвороба Помпе та ін.
Глікогеноз (I тип - хвороба Гірке). У хворих у печінці, нирках та слизовій оболонці кишечника накопичується велика кількість глікогену. Перетворення їх у глюкозу немає, т.к. відсутній фермент глюко-6-фосфатаза, що регулює рівень глюкози в крові. В результаті у хворого розвивається гіпоглікемія, у печінці, нирках та слизовій оболонці кишечника накопичується глікоген. Хвороба Гірке успадковується за аутосомно-рецесивним типом.
Відразу після народження головними симптомами хвороби є глікогемічні судоми та гепатомегалія (збільшення печінки). З 1-го року життя відзначається затримка зростання. Характерний вид хворого: велика голова, "лялькове обличчя", коротка шия, виступаючий живіт. Крім того, наголошуються носові кровотечі, затримка фізичного та статевого розвитку, м'язова гіпотонія. Інтелект у своїй нормальний. У крові підвищується рівень сечової кислоти, тому з віком може розвинутися подагра.
Як лікування використовується дієтотерапія: частий прийом їжі, підвищений вміст вуглеводів та обмеження жирів у дієті.
Глікогеноз (II тип - хвороба Помпе) протікає у більш тяжкій формі. Глікоген накопичується як у печінці, так і в скелетних м'язах, міокарді, легенях, селезінці, надниркових залозах, стінках судин, у нейронах.
У новонароджених через 1-2 місяці з'являється м'язова слабкість, дефіцит 1,4-глюкозидази в печінці та м'язах. У цей період виникають кардіомегалія (збільшення серця) і макроглоссия (патологічне збільшення мови). Нерідко у хворих розвивається важка форма пневмонії через накопичення секрету дихальних шляхах. Діти вмирають на першому році життя.
Хвороба успадковується за аутосомно-рецесивним типом. Ген локалізовано на довгому плечі 17-ї хромосоми. Діагностика захворювання можлива ще до народження дитини. З цією метою визначають активність ферменту 1,4-глюкозидази в амніотичній рідині та її клітинах.
Галактоземія.
При цьому захворюванні відбувається накопичення в крові хворого на галактозу, що призводить до ураження багатьох органів: печінки, нервової системи, очей та ін. Симптоми хвороби з'являються у новонароджених після прийому молока, оскільки галактоза складова частинамолочного цукру лактози. При гідролізі лактози утворюються глюкоза та галактоза. Остання необхідна мієлінізації нервових волокон. При надлишку галактози в організмі вона в нормі перетворюється на глюкозу за допомогою ферменту галактоза-1-фосфат-уриділтрансферази. При зниженні активності цього ферменту відбувається накопичення галактозу-1-фосфату, токсичного для печінки, мозку, кришталика ока.
Хвороба проявляється з перших днів життя розладами травлення, інтоксикацією (пронос, блювання, зневоднення). У хворих збільшується печінка, розвивається печінкова недостатність та жовтяниця. Виявляється катаракта (помутніння кришталика ока), розумова відсталість. У загиблих у перший рік життя дітей під час розтину виявляють цироз печінки.
Найбільш точні методи діагностики галактоземії – визначення активності ферменту галактоза-1-фосфат-уридилтрансферази в еритроцитах, а також галактози у крові та сечі, де рівні її збільшені. При виключенні з їжі молока (джерела галактози) та ранньому призначенні дієти хворі діти можуть нормально розвиватися.
Тип успадкування галактоземії – аутосомно-рецесивний. Ген локалізовано на короткому плечі 9-ї хромосоми. Хвороба зустрічається із частотою 1 на 16.000 новонароджених.
Спадкові захворювання, пов'язані з порушенням
ліпідного обміну
Спадкові хвороби обміну ліпідів (ліпідози) поділяються на два основні типи:
1) внутрішньоклітинні, у яких відбувається накопичення ліпідів у клітинах різних тканин;
2) хвороби з порушенням метаболізму ліпопротеїдів, що містяться у крові.
До найбільш вивчених спадкових захворювань ліпідного обміну першого типу належать хвороба Гоше, хвороба Німанна-Піка та амавротична ідіотія (хвороба Тея-Сакса).
Хвороба Гоше
характеризується накопиченням цереброзидів у клітинах нервової та ретикуло-ендотеліальної системи, обумовленим дефіцитом ферменту глюкоцереброзідази. Це призводить до накопичення у клітинах ретикуло-ендотеліальної системи глюкоцереброзиду. У клітинах мозку, печінки, лімфатичних вузлах виявляються великі клітини Гоше. Накопичення цереброзиду в клітинах нервової системи призводить до їхнього руйнування.
Виділяють дитячу та ювенільну форми хвороби. Дитяча проявляється у перші місяці життя затримкою розумового та фізичного розвитку, збільшенням живота, печінки та селезінки, утрудненням ковтання, спазмом гортані. Можлива дихальна недостатність, інфільтрація (ущільнення легень клітинами Гоше) та судоми. Смерть настає на першому році життя.
Найчастіше зустрічається ювенільна форма хвороби Гоше. Вона вражає дітей різного вікуі має хронічний характер. Захворювання проявляється, як правило, на першому році життя. Виникають пігментація шкіри (коричневі плями), остеопороз (зниження щільності кістки), переломи, деформація кісток. У тканинах мозку, печінки, селезінки, кісткового мозку міститься велика кількість глюкоцереброзидів. У лейкоцитах, клітинах печінки та селезінки знижено активність глюкозидази. Тип успадкування – аутосомно-рецесивний. Ген локалізовано на довгому плечі 1-ї хромосоми.
Хвороба Німан-Піка
обумовлена зниженням активності ферменту сфінгомієлінази. В результаті відбувається накопичення сфінгомієліну в клітинах печінки, селезінці, мозку, ретикуло-ендотеліальній системі. Внаслідок дегенерації нервових клітин порушується діяльність нервової системи.
Виділяють кілька форм захворювання, що різняться клінічно (час початку, перебіг та тяжкість неврологічних проявів). Проте є й загальні всім форм симптоми.
Хвороба частіше виявляється в ранньому віці. У дитини збільшуються лімфатичні вузли, розміри живота, печінки та селезінки; відзначаються блювання, відмова від їжі, м'язова слабкість, зниження слуху та зір. У 20-30% дітей на сітківці очі виявляється пляма вишневого кольору (симптом вишневої кісточки). Поразка нервової системи веде до відставання нервово-психічного розвитку, глухоті, сліпоті. Різко знижується стійкість до інфекційних захворювань. Діти гинуть у ранньому віці. Спадкування хвороби – аутосомно-рецесивне.
Діагностика хвороби Німанна-Піка заснована на виявленні в плазмі крові та спинномозкової рідини підвищеного вмісту сфінгомієліну. У периферичній крові виявляються великі зернисті пінисті клітини Піка. Лікування симптоматичне.
Амавротична ідіотія (хвороба
Тея-Сакса)
також відноситься до захворювань, пов'язаних із порушенням ліпідного обміну. Для неї характерне відкладення у клітинах мозку, печінки, селезінки та інших органах ліпіду гангліозиду. Причина – зниження активності ферменту гексозамінідази А в організмі. Через війну відбувається руйнація аксонів нервових клітин.
Хвороба проявляється у перші місяці життя. Дитина стає млявою, малорухливою, байдужою до оточуючих. Затримка психічного розвитку призводить до зниження інтелекту до ступеня ідіотії. Відзначається м'язова гіпотонія, судоми, характерний симптом вишневої кісточки на сітківці ока. До кінця першого року життя настає сліпота. Причина – атрофія зорових нервів. Пізніше розвивається повна знерухомленість. Смерть настає у 3-4 роки. Тип успадкування хвороби – аутосомно-рецесивний. Ген локалізовано на довгому плечі 15-ї хромосоми.
Спадкові хворобисполучної тканини
Сполучна тканина в організмі виконує опорну, трофічну та захисну функції. Складна структура сполучної тканини задана генетично. Патологія в її системі є причиною різних спадкових захворювань та обумовлена в тій чи іншій мірі порушеннями будови структурних білків – колагенів.
Більшість хвороб сполучної тканини пов'язані з дефектами опорно-рухового апарату та шкіри. До них належать синдром Марфана, мукополісахаридози.
Синдром Марфана
належить до спадкових хвороб обміну речовин і характеризується системним ураженням сполучної тканини. Наслідує аутосомно-домінантний тип з високою пенетрантністю і різним ступенем експресивності. З цим пов'язаний значний клінічний та віковий поліморфізм. Вперше синдром був описаний В. Марфаном у 1886 р. Причина хвороби – мутація в гені, відповідальному за синтез білка сполучнотканинних волокон фібриліну. Блокування його синтезу призводить до підвищеної розтяжності сполучної тканини.
Хворих із синдромом Марфана відрізняють високий ріст, довгі пальці, деформація грудної клітки (воронкоподібна, кільоподібна, сплощена), плоскостопість. Нерідко мають місце стегнові та пахвинні грижі, гіпоплазія (недорозвинення) м'язів, м'язова гіпотонія, погіршення зору, зміна форми та розміру кришталика, міопія (аж до відшарування сітківки), гетерохромія (різне фарбування ділянок райдужної оболонки); підвивих кришталика, катаракта, косоокість.
Крім перерахованого, при синдромі Марфана характерні вроджені вади серця, розширення аорти з недостатнім розвитком аневризми. Нерідко відзначаються розлади органів дихання, ураження шлунково-кишковий трактта сечовивідної системи.
Лікування переважно симптоматичне. Позитивну дію мають масаж, лікувальна фізкультура, а в ряді випадків оперативне втручання. Велике значення має рання діагностика захворювання. Частота синдрому Марфана у популяції дорівнює 1:10.000 (1:15.000).
Синдромом Марфана страждали президент США Авраам Лінкольн, великий італійський скрипаль та композитор Ніколо Паганіні.
Мукополісахаридози
представлені цілою групою спадкових захворювань сполучної тканини. Для них характерне порушення в організмі метаболізму кислих глікозаміногліканів, що пов'язано з недостатністю лізосомальних ферментів. В результаті патологічні продукти обміну відкладаються в сполучній тканині, печінці, селезінці, рогівці та в клітинах центральної нервової системи. Перші відомості про мукополісахаридози з'явилися в 1900 р., а потім у 1917-1919 рр.
При мукополісахаридозах уражаються опорно-руховий апарат, внутрішні органи, очі, нервова система. Клінічними ознаками хвороби служать: уповільнення росту, коротка шия та тулуб, деформація кісток, зниження інтелекту, грубі риси обличчя з великими губами та язиком, пупкові та пахвинні грижі, вади серця, порушення психічного розвитку з відставанням від норми.
Тип успадкування хвороби – аутосомно-рецесивний. Ген картований на короткому плечі 4-ї хромосоми.
Усього виділяють 8 основних типів мукополісахаридозів залежно від зниження активності різних ферментів та особливостей клінічних ознак. Для визначення типу захворювання досліджуються біохімічні показники кислих глікозаміноглюканів у крові та сечі хворих.
Лікування: дієтотерапія, фізіопроцедури (електрофорез, магнітотерапія, масаж, лікувальна фізкультура та ін), гормональні та серцево-судинні засоби.
Спадкові порушенняобміну в еритроцитах
Гемолітичні анемії
включають захворювання, зумовлені зниженням рівня гемоглобіну та укороченням терміну життя еритроцитів. Крім того, причиною хвороби можуть бути:
Порушення мембрани еритроцитів.
Порушення активності ферментів еритроцитів (ферментів, гліколізу пентозофосфатного циклу та ін.).
Порушення структури чи синтезу гемоглобіну.
Найбільш поширена форма спадкової гемолітичної анемії у людини – спадковий мікросфероцитоз -
гемолітична анемія Мінків
ського-Шоффара.
Хвороба описана 1900г. Приблизно у половині випадків вона проявляється у новонароджених. Діагноз ставиться віком 3-10 років. Захворювання обумовлено генетичними аномаліями еритроцитів та пов'язане з вродженою недостатністю ліпідів їхньої оболонки. В результаті підвищення проникності мембрани в клітину проникають іони натрію і втрачається АТФ. Еритроцити набувають сферичної форми. Змінені еритроцити руйнуються у селезінці з утворенням токсичного білка – білірубіну.
При цьому захворюванні відзначають жовтяницю, анемію, спленомегалію (розрив селезінки), зміни скелета. Хвороба може протікати у двох формах – хронічній та гострій, при якій посилюється гемоліз, що зумовлює анемію.
У дітей у перші місяці життя часто виникає «ядерна жовтяниця». Причина – ураження ядер головного мозку за рахунок високого вмісту білірубіну. У більш старшому віці високий рівень білірубіну призводить до утворення каменів та розвитку жовчнокам'яної хвороби.
Для хворих характерне збільшення селезінки та печінки, деформація скелета, порушення розташування зубів.
Тип успадкування – аутосомно-домінантний з неповною пенетрантністю. Ген картований на короткому плечі 8-ї хромосоми.
Спадкові аномаліїциркулюючих білків.Гемоглобінопатії- це хвороби, пов'язані зі спадковим порушенням синтезу гемоглобіну. Виділяють кількісні (структурні) та якісні їх форми. Перші характеризуються зміною первинної структури білків гемоглобіну, що може призводити до порушення його стабільності та функції. За якісних форм структура гемоглобіну залишається нормальною, знижена лише швидкість синтезу глобінових ланцюгів.
Таласемії.
Ця патологія обумовлена зниженням швидкості синтезу поліпептидних ланцюгів нормального гемоглобіну А. Вперше хвороба описана в 1925 р. Її назва походить від грецького «Таласа» – Середземне море. Вважають, що із середземноморським регіоном пов'язане походження більшості носіїв гена таласемії.
Таласемія зустрічається в гомо-і гетерозиготних формах. За клінічною картиною прийнято розрізняти велику, проміжну, малу та мінімальну форми. Зупинимося на одній із них.
Гомозиготна (велика) талассе
мія, вона ж - анемія Кулі
викликається різким зниженням утворення гемоглобіну HbA 1 та збільшенням кількості гемоглобіну F.
Клінічно хвороба проявляється до кінця першого року життя дитини. Для неї характерні монголоїдність обличчя, баштовий тип черепа, відставання фізичного розвитку. При даній патології в крові хворого виявляються мішенеподібні еритроцити з низьким вмістом Нв, укороченою тривалістю життя та підвищеною осмотичною стійкістю. У хворих відзначається збільшення селезінки та, рідше, печінки.
За тяжкістю захворювання виділяють кілька форм таласемії. Тяжка таласемія закінчується швидкою загибеллю в перші місяці життя дитини. При хронічній – хворі діти доживають до 5-8 років, а за легких форм хворі доживають до дорослого віку.
Серповидноклітинна анемія
- Спадкове захворювання, що найчастіше зустрічається, викликане зміною структури молекули гемоглобіну. Люди, які страждають на серповидно-клітинну анемію, в більшості випадків гинуть, не досягнувши зрілого віку. В умовах низького парціального тиску кисню їх еритроцити набувають форми серпу. У батьків хворого еритроцити мають дещо змінену форму, але вони не страждають на анемію.
Це захворювання вперше виявив у 1910 р. Дж. Херрік у студента, який страждав на тяжку форму анемії. У крові хворого він виявив еритроцити незвичайної серповидної форми.
У 1946 р. Нобелівський лауреат Л. Полінг з колегами провели біохімічний та генетичний аналіз гемоглобіну хворих та здорових людейі показали, що гемоглобіни нормальних та серповидноклітинних еритроцитів розрізняються по рухливості в електричному полі та розчинності. Виявилося, що гемоглобін у людей з ознаками серповидноклітинності є сумішшю рівних кількостей і нормального і мутантного гемоглобіну. Стало ясно, що мутація, що викликає серповидноклітинну анемію, пов'язана із зміною хімічної структури гемоглобіну. Подальші дослідження показали, що у разі серповидноклітинної анемії відбувається заміна глютамінової кислоти на валін у шостій парі нуклеотидів гена, що кодує бета-ланцюг гемоглобіну людини. У гетерозигот змінений гемоглобін становить 20-45%, у гомозигот - 60-99% загального гемоглобіну.
При цій патології відзначають блідість шкіри та слизових оболонок, жовтяничність. У 60% дітей збільшено печінку. Відзначається також шуми у серці та інших. Хвороба протікає як чергування кризів і ремісій.
Спеціальних методів лікування немає. Важливе значення має захист хворого від впливу факторів, що провокують розвиток хвороби (гіпоксія, зневоднення, холод та ін.).
Хромосомні хвороби людини
Хромосомні хвороби – це велика групауроджених спадкових хвороб із множинними вродженими вадами розвитку. У їх основі лежать хромосомні чи геномні мутації. Ці два різні типи мутацій для стислості об'єднують терміном «хромосомні аномалії».
Виділення щонайменше трьох хромосомних хвороб як клінічних синдромів уроджених порушень розвитку зроблено до встановлення їх хромосомної природи.
Найбільш часто зустрічається хвороба, трисомія 21, клінічно була описана в 1866 англійським педіатром Л. Дауном і отримала назву «синдром Дауна». Надалі причина синдрому неодноразово піддавалася генетичному аналізу. Висловлювалися припущення про домінантну мутацію, про вроджену інфекцію, про хромосомну природу.
Перший клінічний опис синдрому моносомії по Х-хромосомі як окремої форми хвороби було зроблено російським клініцистом Н.А. Шерешевським у 1925р., а в 1938р. Г. Тернер також описав цей синдром. На прізвище цих учених моносомію за Х-хромосомою називають синдромом Шерешевського-Тернера.
Аномалії в системі статевих хромосом у чоловіків (трисомія XXY) як клінічний синдром вперше описав Г. Клайнфелтер у 1942 р. Перелічені захворювання стали об'єктом перших клініко-цитогенетичних досліджень, проведених у 1959 р.
Етіологічними факторами хромосомної патології є всі види хромосомних мутацій та деякі геномні мутації. Хоча геномні мутації в тваринному та рослинному світі різноманітні, у людини виявлено лише 3 типи геномних мутацій: тетраплоідія, триплоїдія та анеуплоїдія. З усіх варіантів анеуплоїдій зустрічаються тільки трисомії за аутосомами, полісомії за статевими хромосомами (три-, тетра-і пентасомії), а з моносомії зустрічається тільки моносомія X.
Що стосується хромосомних мутацій, то у людини виявлені всі типи (делеції, дуплікації, інверсії, транслокації). До хромосомних належать хвороби, зумовлені геномними мутаціями чи структурними змінами окремих хромосом.
В основі класифікації хромосомної патології лежать три принципи, що дозволяють точно охарактеризувати форму хромосомної патології.
Перший принцип - етіологічний - характеристика хромосомної чи геномної
мутації
(триплоїдія, проста трисомія за хромосомою 21, часткова моносомія і т.д.) з урахуванням конкретної хромосоми. Для кожної форми хромосомної патології встановлюється яка структура залучена в патологічний процес (хромосома, сегмент) і в чому полягає генетичне порушення (недолік або надлишок хромосомного матеріалу). Диференціація хромосомної патології виходячи з клінічної картини немає істотного значення, оскільки різним хромосомним аномаліям властива велика спільність порушень розвитку.
Другий принцип - визначення типу клітин, у яких виник
ла мутація
(У гаметах або зиготі). Гаметичні мутації ведуть до повних форм хромосомних хвороб. У таких індивідів усі клітини несуть успадковану з гаметою хромосомну аномалію. Якщо хромосомна аномалія виникає у зиготі чи ранніх стадіях дроблення (такі мутації називають соматичними, на відміну гаметичних), то розвивається організм із клітинами різної хромосомної конституції (два і більше). Такі форми хромосомних хвороб називають мозаїчними. Для виникнення мозаїчних форм, що за клінічною картиною збігаються з повними формами, потрібно не менше 10% клітин з аномальним набором.
Третій принцип – це виявлення покоління, в якому виникло
ла мутація
:
виникла вона наново у гаметах здорових батьків (спорадичні випадки) або батьки вже мали таку аномалію (успадковані, або сімейні форми). З покоління до покоління передаються трохи більше 3-5 %
з них. Хромосомними порушеннями зумовлені приблизно 50% спонтанних абортів та 7% усіх мертвонароджень.
Усі хромосомні хвороби прийнято поділяти на дві групи.
Хвороби, пов'язані з аномаліямичисла хромосом
До цієї групи входять три підгрупи:
Хвороби, зумовлені порушенням числа
Хвороби, пов'язані із збільшенням або зменшенням числа статевих Х- та Y-хромосом.
3.Хвороби, причиною яких є поліплоїдія
Кратне збільшення гаплоїдного набору хромосом.
Хвороби, пов'язані зі структурнимипорушеннями
(абераціями)хромосом
Їхні причини бувають:
Транслокації – обмінні перебудови між негомологічними хромосомами.
Делеції – втрати ділянки хромосоми.
Інверсії – повороти ділянки хромосоми на 180 градусів.
Дуплікації - подвоєння ділянки хромосоми
Ізохромосомія - хромосоми з генетичним матеріалом, що повторюється, в обох плечах.
Виникнення кільцевих хромосом (з'єднання двох кінцевих делецій в обох плечах хромосоми).
В даний час у людини відомо понад 700 захворювань, спричинених структурними порушеннями хромосом. Наявні дані показують, що близько 25% посідає аутосомні трисомії, 46% - на патологію статевих хромосом. Структурні перебудови становлять 104%. Серед хромосомних перебудов найчастіше зустрічаються транслокації та делеції.
Хвороби, пов'язані з аббераціями хромосом
Синдром Дауна (трисомія по 21-й
хромосомі).
Найбільш поширеним захворюванням з кількісним порушенням хромосом відноситься трисомія 21 (наявність 47 хромосом замість 46 за рахунок зайвої хромосоми 21-ї пари). Трисомія 21, або синдром Дауна,зустрічається з частотою 1 на 700-800 народжень, не має будь-якої тимчасової, етнічної чи географічної різниці при однаковому віці батьків. Дане захворювання відноситься до найбільш поширених і вивчених патологій людини. Частота народження дітей із хворобою Дауна залежить від віку матері та меншою мірою від віку батька.
З віком суттєво збільшується ймовірність народження дітей із синдромом Дауна. Так, у жінок віком 45 років вона становить близько 3%. Висока частота дітей з синдромом Дауна (близько 2%) спостерігається у жінок, що рано народжують (до 18 років). Отже, для популяційних порівнянь частоти народження дітей з синдромом Дауна треба брати до уваги розподіл жінок, що народжують за віком (частка жінок, що народжують після 30-35 років, в загальній кількості народжують). Цей розподіл іноді змінюється протягом 2-3 років для одного й того самого населення (наприклад, при різкій зміні економічної ситуації в країні). Зростання частоти синдрому Дауна зі збільшенням материнського віку відоме, але більшість дітей із синдромом Дауна все-таки народжені матерями молодше 30 років. Це з великим числом вагітностей у цій вікової групі проти жінками старшого віку.
У літературі описано «пучковість» народження дітей із синдромом Дауна у певні проміжки часу у деяких країнах (містах, провінціях). Ці випадки можна пояснити радше стохастичними коливаннями спонтанного рівня нерозбіжності хромосом, ніж впливом передбачуваних етіологічних чинників (вірусна інфекція, низькі дози радіації, хлорофос).
Клінічно синдром Дауна був описаний в 1866 р. Його генетична природа була розшифрована значно пізніше - в 1959 р., коли Лежен зі співробітниками виявили в каріотипі цих хворих зайву хромосому 21. Описані і більш рідкісні цитогенетичні варіанти хвороби Дауна - транслокаційний. На транслокаційний варіант припадає близько 3% випадків. Число хромосом у каріотипі таких хворих нормальне - 46, оскільки додаткова 21 хромосома транслокована (переміщена) на іншу аутосому. Мозаїчні варіанти становлять 2% всіх випадків захворювання.
Співвідношення хлопчиків та дівчаток із синдромом Дауна становить 1:1.
Клінічна симптоматика синдрому Дауна різноманітна: це і вроджені вади розвитку, порушення постнатального розвитку нервової системи, і вторинний імунодефіцит тощо. Діти з синдромом Дауна народжуються вчасно, але з помірно вираженою пренатальною гіпоплазією (на 8-10% нижче за середні величини). Багато симптомів синдрому Дауна помітні вже при народженні і надалі виявляються чіткіше. Кваліфікований педіатр встановлює правильний діагнозсиндрому Дауна в пологовому будинку не менш як у 90% випадків. З черепно-лицьових дизморфій відзначаються монголоїдний розріз очей (з цієї причини синдром Дауна довго називали монголоїдизмом), брахіцефалія, кругле сплощене обличчя, плоска спинка носа, епікант, велику (зазвичай висунуту) мову, деформовані вушні раковини. М'язова гіпотонія поєднується з розболтанням суглобів. Часто зустрічаються вроджена вада серця, типові зміни дерматогліфіки (чотирипальцева, або «мавпя», складка на долоні, дві шкірні складки замість трьох на мізинці). Пороки шлунково-кишкового тракту спостерігаються рідко.
Діагноз синдрому Дауна встановлюють виходячи з поєднання кількох симптомів. Наявність 4-5 їх достовірно вказує на синдром Дауна: 1) уплощение профілю особи (90%); 2) відсутність смоктального рефлексу (85%); 3) м'язова гіпотонія (80%); 4) монголоїдний розріз очних щілин (80%); 5) надлишок шкіри на шиї (80%); 6) розбовтаність суглобів (80%); 7) диспластичний таз (70%); 8) диспластичні (деформовані) вушні раковини (60%); 9) клинодактилія мізинця (60%); 10) чотирипальцева згинальна складка (поперечна лінія) долоні (45%). Зростання дорослих хворих на 20 см нижче середнього.
Реакція дітей із синдромом Дауна на впливи навколишнього середовища часто патологічна у зв'язку зі слабким клітинним та гуморальним імунітетом, зниженням репарації ДНК, недостатнім виробленням травних ферментів, обмеженими компенсаторними можливостями всіх систем. З цієї причини діти з синдромом Дауна часто хворіють на пневмонії, важко переносять дитячі інфекції. У них відзначається нестача маси тіла, виражений гіповітаміноз.
Вроджені вади внутрішніх органів, знижена пристосованість дітей із синдромом Дауна часто призводять до смерті у перші 5 років. Наслідком зміненого імунітету та недостатності репараційних систем (для пошкодженої ДНК) є лейкози, що часто виникають у хворих із синдромом Дауна.
Розумовий розвиток хворих із синдромом Дауна відстає. Затримка розумового розвитку може досягати рівня імбецильності без особливих способів навчання. Коефіцієнт розумового розвитку(англ. IQ) у різних дітей може становити від 25 до 75. Діти з синдромом Дауна ласкаві, уважні, слухняні, терплячі під час навчання.
Діагностика цього синдрому не викликає особливих труднощів. Важливою проблемою в даний час є докорінна зміна громадської думки та думки фахівців щодо навчання цих дітей, необхідності навчання та інтеграції в середу здорових однолітків, важливості розробки та реалізації спеціальних програм з їх соціальної адаптації та творчого розвитку.
90% дітей із синдромом Дауна, народжених у Росії, батьки залишають під опікою держави. Батьки часто не знають, що за правильного навчання такі діти можуть стати повноцінними членами суспільства.
Лікувальна допомога дітям із синдромом Дауна багатопланова та неспецифічна. Вроджені вади серця усуваються оперативно. Постійно проводиться загальнозміцнююче лікування. Харчування має бути повноцінним. Необхідний уважний догляд за хворою дитиною, захист від дії шкідливих факторів довкілля (застуда, інфекції). Великі успіхи у збереженні життя дітей із синдромом Дауна та їх розвитку забезпечують спеціальні методи навчання, зміцнення фізичного здоров'я з раннього дитинства, деякі форми лікарської терапії, спрямовані на покращення функцій ЦНС. Багато хворих з трисомією тепер здатні вести самостійне життя, опановують нескладні професії, створюють сім'ї.
Синдром Патау (трисомія по 13-й
хромосомі)
описаний 1960г. у дітей з множинними вродженими вадами розвитку. Зустрічається у новонароджених із частотою 1:5000 – 1:7000. Хвороба обумовлена трисомією по 13-й хромосомі у 80-85% хворих із синдромом Патау. Нерозбіжність хромосом у мейозі відбувається найчастіше в матері. Хлопчики та дівчатка з синдромом Патау народжуються з однаковою частотою.
Характерне ускладнення вагітності при виношуванні плода із синдромом Патау – багатоводдя: воно зустрічається майже у 50% випадків. Синдром Патау супроводжується множинними вродженими вадамирозвитку головного мозку та обличчя. Це патогенетично єдина група ранніх (і, отже, тяжких) порушень формування головного мозку, очних яблук, кісток мозкової та лицьової частин черепа. Окружність черепа зазвичай зменшена. Лоб скошений, низький; очні щілини вузькі, перенесення запале, вушні раковини низько розташовані та деформовані. Типова ознака синдрому Патау - ущелини верхньої губиі піднебіння (зазвичай двосторонні). Завжди виявляються вади декількох внутрішніх органів у різних комбінаціях: дефекти перегородок серця, незавершений поворот кишечника, кісти нирок, аномалії внутрішніх статевих органів (у дівчаток - це подвоєння матки та піхви, у хлопчиків - крипторхізм - затримка яєчка при спусканні в мошонку), дефекти залози. Як правило, спостерігаються полідактилія (частіше двостороння та на руках). У 80-85% хворих виявляється глухота. При народженні хворі діти відрізняються малою вагою, хоча народжуються вчасно.
У зв'язку з тяжкими вродженими вадами розвитку більшість дітей із синдромом Патау помирають у перші тижні або місяці життя (95% помирають до 1 року). Проте деякі хворі мешкають кілька років. Більше того, у розвинених країнах відзначається тенденція збільшення тривалості життя хворих із синдромом Патау до 5 років (близько 15% хворих) і навіть до 10 років (2-3% хворих).
Лікувальна допомога дітям із синдромом Патау неспецифічна: операції з приводу вроджених вад розвитку (за життєвими показаннями), загальнозміцнююче лікування, ретельний догляд, профілактика простудних та інфекційних хвороб. Діти із синдромом Патау практично завжди глибокі ідіоти.
Синдром Едвардса (трисомія по
18-й хромосомі).
Описаний 1960г. Едвардс. Частота хворих серед новонароджених дорівнює 1:5000 – 1:7000. Співвідношення хлопчиків та дівчаток із синдромом Едвардса становить 1:3. Причини переважання хворих дівчаток поки що не відомі. Майже завжди синдром Едвардса обумовлений простою трисомною формою (гаметична мутація в одного з батьків).
При синдромі Едвардса відзначається виражена затримка пренатального розвитку за нормальної тривалості вагітності (пологи вчасно). Найбільш характерними особливостями синдрому є множинні вроджені вади розвитку лицьової частини черепа, серця, кісткової системи, статевих органів. Череп доліхоцефалічної (подовженої) форми; Нижня щелепата отвір рота маленькі; очні щілини вузькі та короткі; вушні раковини деформовані та низько розташовані. З інших зовнішніх ознак відзначаються флексорне положення кистей, аномальна стопа (п'ята виступає, склепіння провисає), I палець стоп коротший за II пальці. Спинномозкова грижа та ущелина губи зустрічаються рідко (5% випадків синдрому Едвардса).
Діти із синдромом Едвардса помирають у ранньому віці (90% до 1 року) від ускладнень, зумовлених вродженими вадами розвитку (асфіксія, пневмонія, кишкова непрохідність, серцево-судинна недостатність).
Синдроми, зумовленівнутрішньохромосомними
перебудовами
До цього типу перебудов хромосом (поряд із делеціями, дуплікаціями та інверсіями) відносяться часткові трисомії та моносомії аутосом.
Синдром «котячого крику»
пов'язаний з делецією короткого плеча 5-ї хромосоми. Вперше описаний Дж.Леженом в 1963 р. Ознакою його є незвичайний плач дітей, що нагадує нявкання або крик кішки. Це з патологією гортані чи голосових зв'язок. Однак із віком цей крик зникає.
Клінічна картина синдрому значно варіює. Найбільш типовим, крім «котячого крику», є розумовий та фізичний недорозвинення, мікроцефалія (аномально зменшена голова).
Своєрідний зовнішній вигляд хворих: місяцеподібна особа, мікрогенія (маленькі розміри верхньої щелепи), епікант (вертикальна складка шкіри біля внутрішнього кута очної щілини), високе небо, плоска спинка носа, косоокість. Вушні раковини розташовані низько та деформовані. Відзначаються також вроджені вади серця, патологія кістково-м'язової системи, синдактилія стоп (повне або часткове зрощення сусідніх пальців), плоскостопість, клишоногість та ін, м'язова гіпотонія.
Більшість дітей помирає у ранньому віці. Водночас відомі описи хворих віком від 50 років. Популяційна частота синдрому «котячого крику» 1:40000 – 1:50000 новонароджених. Розмір делеції у різних випадках різний.
Синдром Вольфа-Хіршхорна
вперше описаний у 1965р. У 80% новонароджених, що страждають ним, цитологічну основу даного синдрому становить делеція короткого плеча 4-ї хромосоми. Зазначається, що більшість делецій виникає заново, близько 13% відбувається внаслідок транслокацій у батьків. Рідше в геном хворих, крім траснлокації, є і кільцеві хромосоми. Поряд із поділами хромосом, патологія у новонароджених може бути обумовлена інверсіями, дуплікаціями, ізохромосомами.
Хвороба характеризується численними вродженими вадами розвитку, затримкою розумового та психомоторного розвитку.
У новонароджених невелика вага при нормальній тривалості вагітності. Серед зовнішніх ознак відзначаються: мікроцефалія, дзьобоподібний ніс, епікант, антимонголоїдний розріз очей (опущення зовнішніх кутів очних щілин), аномальні вушні раковини, ущелина верхньої губи та неба, маленький рот, деформація стоп та ін.
Частота цього синдрому низька – 1:100000 народжень.
Життєздатність дітей різко знижена, більшість помирає у віці до 1 року. Описаний лише 1 хворий віком 25 років.
Синдроми з числовимианомаліями статевих хромосом
Синдром Шерешевського-Тернера
вперше описано Н.А. Шерешевським 1925 р., а пізніше, 1938 р. Х.Х. Тернером. Причиною хвороби є порушення розходження статевих хромосом. Хворіють лише жінки, вони відсутні одна Х-хромосома (45 ХО).
Частота народження синдрому 1:3000 новонароджених дівчаток. Зазначається, що тільки у 20% жінок вагітність хворим на плод зберігається до кінця і народжується жива дитина. В інших випадках відбувається мимовільний аборт або мертвонародження.
Для синдрому характерні: низькорослість, статевий інфантилізм, соматичні порушення. У дітей вже на першому році життя відзначається відставання у зростанні, що стає найчіткіше помітно до 9-10 років. Середнє зростання хворих дорослих жінок становить середньому 135 див. Вони мають аномалії у розвитку скелета: коротка шия з бічними шкірними складками, коротка і широка грудна клітина, надмірна рухливість ліктьових і колінних суглобів, укорочення 4-5-го пальців на руках. Характерний зовнішній вигляд хворих: мікрогнатія (недорозвиток нижньої щелепи), епікант, низькопосаджені деформовані вуха, високе тверде небо та ін. Нерідко відзначається косоокість, катаракта, дефекти слуху, аномалії сечової системи (подвоєння нирок, сечовивідних шляхів).
Важливою особливістю цього захворювання є статевий інфантилізм. Внутрішні та зовнішні геніталії недорозвинені, у період статевого дозрівання вторинні статеві ознаки відсутні або розвинені слабо, недорозвинені піхву та матку, менструацій немає, хворі безплідні. Однак у літературі існують дані про народження дітей у жінок із синдромом Шерешевського-Тернера.
У 50% випадків хворі страждають на розумову відсталість, вони пасивні, схильні до психогенних реакцій і психозів.
Тривалість життя близька до норми. Лікування спрямоване на стимуляцію росту та зменшення статевого інфантилізму (тривалі курси статевих гормонів та ін.).
Синдром полісомії по Х-хромосо
ме у жінок.
Синдром включає трисомію (каріотип 47, ХХХ), тетрасомію (48, ХХХХ), пентасомію (49, ХХХХХ). Найчастіше зустрічається трисомія - 1 на 1000 дівчаток, що народилися. Клінічна картина досить різноманітна. Відзначається незначне зниження інтелекту, підвищена ймовірність розвитку психозів та шизофренії з несприятливим типом течії. Плодючість таких жінок страждає меншою мірою.
При тетра- та пентасомії – X підвищується ступінь розумової відсталості, відзначаються соматичні аномалії, недорозвинення геніталій. Діагностика синдрому полісомії X включає визначення статевого хроматину та дослідження каріотипу хворого. Раціонального лікування немає.
Синдром Клайнфельтера
описаний 1942 р. М. Клайнфельтером. Хворіють лише хлопчики. Частота народження - 2 з 1000 новонароджених хлопчиків. Встановлено, що хворі мають зайву Х-хромосому (каріотип 47, XXY замість 46 XY). Поряд з цим зустрічаються варіанти полісомії з великим числом Х- і Y-хромосом, які також відносять до синдрому Клайнфельтера.
До народження захворювання клінічно не діагностується. Генетичні аномалії виявляються в період статевого дозрівання у вигляді недорозвинення сім'яників та вторинних статевих ознак.
Для чоловіків із синдромом Клайнфельтера характерні високий ріст, євнухоїдний тип складання (широкий таз, вузькі плечі), гінекомастія (розвиток грудних залоз більше, ніж у нормі), слабке зростання волосся на обличчі, пахвових западинах і на лобку. Яєчка зменшено у розмірах, відзначається статевий інфантилізм, схильність до ожиріння. При цьому у хворих порушений сперматогенез і вони є безплідними. Їх розумовий розвиток відстає, проте інколи інтелект нормальний.
Збільшення числа Х-хромосом у генотипі супроводжується посиленням розумової відсталості, порушенням психіки, антисоціальними вчинками та алкоголізмом.
Синдром дисомії щодо
Y
-хромосомі
(47, XYY) описаний 1961 р. Зустрічається з частотою 1 на 1000 новонароджених хлопчиків. Чоловіки з набором хромосом 47 XYY не відрізняються від норми з фізичного та розумового розвитку. Відзначається невелике збільшення зростання – близько 185 см. Іноді спостерігається незначне зниження інтелекту, схильність до агресивних та антисоціальних вчинків. За деякими даними, у місцях ув'язнення чоловіків із генотипом XYY у 10 разів більше, ніж чоловіків із нормальним генотипом.
Фактори, що підвищують ризик народження дітей з
хромосомними хворобами
В останні десятиліття багато дослідників зверталися до причин виникнення хромосомних хвороб. Не викликало сумнівів, що освіта хромосомних аномалій (і хромосомних, і геномних мутацій) відбувається спонтанно. Екстраполювалися результати експериментальної генетики та передбачався індукований мутагенез у людини (іонізуюча радіація, хімічні мутагени, віруси). Однак реально причини виникнення хромосомних та геномних мутацій у зародкових клітинах або на ранніх стадіях розвитку зародка досі не розшифровані.
Перевірялося багато гіпотез нерозбіжності хромосом (сезонність, расово-етнічна приналежність, вік матері та батька, затримане запліднення, порядок народження, сімейне накопичення, лікарське лікування матерів, шкідливі звички, негормональна та гормональна контрацепція, вірусні хвороби у жінок). Найчастіше ці гіпотези не підтвердилися, але генетична схильність до хвороби не виключається. Хоча в більшості випадків нерозбіжність хромосом у людини спорадична, можна припускати, що вона певною мірою генетично детермінована. Про це свідчать такі факти:
потомство з трисомією з'являється в тих самих жінок повторно з частотою щонайменше 1%;
родичі пробанда з трисомією 21 або іншими анеуплоїдією мають дещо підвищений ризик народження дитини з анеуплоїдією;
кровна спорідненість батьків може підвищувати ризик трисомії у потомства;
частота зачатій з подвійною анеуплоїдією може бути вищою, ніж передбачається, відповідно до частоти окремих анеуплоїдій.
До біологічних чинників підвищення ризику нерозбіжності хромосом належить вік матері, хоча механізми цього явища неясні. Ризик народження дитини з хромосомною хворобою, зумовленою анеуплоїдією, з віком матері поступово підвищується, але особливо різко після 35 років. У жінок старше 45 років кожна 5-та вагітність завершується народженням дитини з хромосомною хворобою. Найбільш чітко вікова залежність проявляється для трисомії 21 (хвороба Дауна). Для анеуплоїдій за статевими хромосомами вік батьків або не має значення, або його роль дуже незначна.
З віком підвищується частота спонтанних абортів, яка до 45 років збільшується в 3 рази і більше. Таке становище можна пояснити тим, що спонтанні аборти багато в чому зумовлені (до 40-45%) хромосомними аномаліями, частота яких має вікову залежність.
Хвороби зі спадковою схильністю
(мультифакторіальні)
Хвороби зі спадковою схильністю, на відміну генних хвороб, обумовлені як спадковими, і, значною мірою, чинниками довкілля. Ця група хвороб нині становить 92% від загальної кількості спадкових патологій людини. З віком частота захворювань зростає. У дитячому віці відсоток хворих становить щонайменше 10%,
а в літньому - 25-30%.
До мультифакторіальних хвороб, що найчастіше зустрічаються, відносяться: ревматизм, ішемічна хвороба серця, гіпертонічна і виразкова хвороба, цироз печінки, цукровий діабет, бронхіальна астма, псоріаз, шизофренія та ін.
Хвороби зі спадковим нахилом пов'язані з дією багатьох генів, тому їх називають також мультифакторіальними.
Будучи багатофакторними системами, вони складні генетичного аналізу. Лише останнім часом успіхи у вивченні геному людини та картуванні його генів відкривають можливості виявлення генетичної схильності та основних причин розвитку мультифакторіальних захворювань.
Спадкова схильність може мати моно-або полігенну природу. У першому випадку вона обумовлена мутацією одного гена, для прояву якої необхідний певний зовнішній фактор, а в другому - поєднанням алелей декількох генів і комплексом факторів зовнішнього середовища.
Клінічна картина та тяжкість перебігу мультифакторіальних хвороб людини в залежності від статі та віку дуже різні. Разом з тим, при всій їх різноманітності виділяють такі загальні особливості:
1. Висока частота захворювань у популяції. Так, на шизофренію хворіють близько 1% населення, цукровий діабет - 5%,
алергічними захворюваннями – понад 10%, гіпертонією – близько 30%.
Клінічний поліморфізм захворювань варіює від прихованих субклінічних форм до яскраво виражених проявів.
Особливості спадкування захворювань не відповідають менделівським закономірностям.
Ступінь прояву хвороби залежить від статі та віку хворого на інтенсивність роботи його ендокринної системи, несприятливих факторів зовнішнього та внутрішнього середовища, наприклад, нераціонального харчування та ін.
Генетичний прогноз при мультифакторіальних захворюваннях залежить від наступних факторів:
що нижча частота хвороби у популяції, то вище ризик для родичів пробанда;
що сильніший ступінь виразності хвороби у пробанда, то більше вписувалося ризик розвитку хвороби в його родичів;
ризик для родичів пробанда залежить від ступеня спорідненості із ураженим членом сім'ї;
ризик для родичів буде вищим, якщо пробанд відноситься до менш ураженої статі;
Для оцінки ризику при мультифакторіальній патології збирають емпіричні дані про популяційну та сімейну частоту кожного захворювання або вади розвитку.
Полігенна природа хвороб із спадковою схильністю підтверджується за допомогою генеалогічного, близнюкового та популяційно-статистичного методів. Досить об'єктивний і чутливий близнюковий метод. При його використанні проводять порівняння конкордантності моно-і дизиготних близнюків або порівняння конкордантності монозиготних близнюків, що виросли разом або порізно. Було показано, що конкордантність монозиготних близнюків вища, ніж дизиготних з ряду хвороб серцево-судинної системи (гіпертонії, інфаркту міокарда, інсульту, ревматизму). Це свідчить про генетичну схильність до зазначених захворювань. Вивчення природи злоякісних новоутворень у монозиготних близнюків показало невисоку конкордантність (11%), але водночас вона у 3-4 рази перевищує таку для дизиготних близнюків. Очевидно, що значення зовнішніх факторів (особливо канцерогенних) для виникнення раку набагато більше спадкових.
За допомогою близнюкового методу показана спадкова схильність до деяких інфекційних захворювань (туберкульоз, поліомієліт) та багатьох поширених хвороб (ішемічна хвороба серця, ревматизм, цукровий діабет, виразкова хвороба, шизофренія та ін.).
Розповсюдження мультифакторіальних хвороб у різних популяціях людини може значно варіювати, що пов'язано з різницею генетичних та середовищних факторів. В результаті генетичних процесів, що відбуваються в людських популяціях (відбір, мутації, міграції, дрейф генів), частота генів, що визначають спадкову схильність, може зростати або зменшуватися до повної їх елімінації.
Успіхи програми «Геном людини», виділення та розшифровка молекулярної організації генів, вивчення причин їхньої патології безсумнівно сприятимуть розробці профілактичних заходів та виявленню груп людей, схильних до мультифакторіальних захворювань.
Т Е М А № 8
Медико-генетичне консультування
Нині кількість дітей із тяжкими спадковими захворюваннями у країнах колишнього СНД перевищує один мільйон. На їх лікування витрачаються величезні кошти. У зв'язку з цим діагностика, профілактика та лікування спадкових та вроджених захворювань у дітей набуває великого значення.
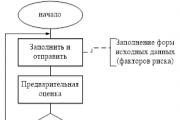
Найбільш ефективним методом профілактики спадкової патології є медико-генетичне консультування, головна мета якого полягає у визначенні прогнозу народження хворих дітей у сім'ї, а також – консультування з питань подальшого планування сім'ї.
Перша медико-генетична консультація була організована наприкінці 20-х років. у Москві найбільшим вітчизняним неврологом та генетиком С.М. Давиденкова при інституті нервово-психіатричної профілактики.
Перший кабінет з медико-генетичного консультування був організований у 1941 р. Дж. Нілом у університеті Мічігану (США). У Росії її у 1932г. під керівництвом С. Г. Левіта було створено медико-генетичний інститут.
Інтенсивний розвиток медико-генетичної допомоги у нашій та інших країнах почався у 60-70 рр. XX ст., що було пов'язано як зі зростанням частки спадкових захворювань, так і з досягненнями у вивченні хромосомної патології та хвороб обміну речовин. За даними 1995 р., біля Російської Федерації існувало 70 медико-генетичних установ, послугами яких користувалися близько 80 тис. сімей.
Основна мета
медико-генетичного консультування – попередження народження хворої дитини. Головними завданнями
медико-генетичного консультування є:
Встановлення точного діагнозу спадкової патології.
Пренатальна (дородова) діагностика вроджених та спадкових захворювань різними методами(ультразвуковими, цитогенетичними, біохімічними, молекулярно-генетичними).
Визначення типу успадкування захворювання.
Оцінка величини ризику народження хворої дитини та надання допомоги у прийнятті рішення.
Пропаганда медико-генетичних знань серед лікарів та населення.
Приводом
для медико-генетичного консультування можуть бути:
Народження дитини з вродженими вадами розвитку, розумовою та фізичною відсталістю, сліпотою та глухотою, судомами та ін.
Спонтанні аборти, викидні, мертвонародження.
Близькоспоріднені шлюби.
Неблагополучний перебіг вагітності.
Робота подружжя на шкідливому підприємстві.
Несумісність подружніх пар за резус-фактором крові.
Вік жінки старше 35 років, а чоловіки – 40 років.
Медико-генетична консультація включає 4 етапи: діагноз; прогноз; висновок; порада.
Робота починається з уточнення діагнозу захворювання. Точний діагноз – необхідна умова для будь-якої консультації. У деяких випадках діагноз спадкової патології може бути встановлений лікарем ще перед направленням до консультації. Це відноситься до добре вивчених і досить часто зустрічається спадкових хвороб, наприклад, хвороби Дауна, цукровому діабету, гемофілії, м'язової дистрофії та ін. Найчастіше діагноз незрозумілий.
У медико-генетичних консультаціях діагноз уточнюється завдяки використанню сучасних генетичних, біохімічних, імуногенетичних та інших методів.
Однією з основних методів є генеалогічний метод, тобто. складання родоводу для подружньої пари, що звернулася до консультації. Насамперед це стосується того з подружжя, у родоводі якого була спадкова патологія. Ретельний збір родоводу дає певну інформацію для встановлення діагнозу хвороби.
У більш складних випадках, наприклад, при народженні дитини з множинними вадами розвитку, правильний діагноз може бути поставлений лише при використанні спеціальних методів дослідження. У процесі діагностики нерідко виникає потреба обстеження як пацієнта, а й інших членів сім'ї.
Після встановлення діагнозу визначається прогноз потомства, тобто. величина повторного ризику народження хворої дитини Основою для вирішення цього завдання є теоретичні розрахунки з використанням методів генетичного аналізута варіаційної статистики або таблиць емпіричного ризику. Це входить до функцій лікаря-генетика.
Передача спадкових захворювань може бути декількома шляхами залежно від особливостей передачі спадкової патології. Наприклад, якщо дитина має захворювання, як в одного з батьків, це вказує на домінантний тип успадкування. У такому разі за повної пенетрантності гена хворі члени сім'ї передадуть захворювання половині своїх дітей.
Спадкова патологія у дитини здорових батьків свідчить про рецесивний тип успадкування. Ризик народження хворої дитини у батьків із рецесивним захворюванням становить 25%. За даними 1976 р. у людини було відомо 789 рецесивно успадкованих захворювань та 944, успадкованих за домінантним типом.
Спадкова патологія може бути зчеплена зі статтю (Х-зчеплений тип успадкування). У цих умовах ризик захворювання у хлопчиків та носій у дівчаток становить 50%. Таких захворювань зараз відомо близько 150.
У разі мультифакторіальних хвороб генетичне консультування є досить точним. Ці хвороби обумовлені взаємодією багатьох генів із чинниками довкілля. Число патологічних генів та їх відносний внесок у захворювання у більшості випадків невідомі. Для розрахунку генетичного ризику використовують спеціально розроблені таблиці емпіричного ризику при мультифакторіальних захворюваннях.
Генетичний ризик до 5% вважається низьким і не є протипоказанням до народження дитини в сім'ї. Ризик від 6 до 20% вважається середнім, й у разі подальшого планування сім'ї рекомендується всебічне обстеження. Генетичний ризик понад 20% прийнято відносити до високому ризику. Подальше дітонародження у цій сім'ї не рекомендується.
При хромосомних хворобах ймовірність повторного народження хворої дитини вкрай низька і не перевищує 1% (за відсутності інших факторів ризику).
Для транслокаційної форми хвороби Дауна при обчисленні ризику важливо визначити, хто з батьків несе збалансовану транслокацію. Наприклад, при транслокації (14/21) величина ризику дорівнює 10%, якщо носієм є мати, і 2,5% - якщо носій батько. При транслокації 21-ї хромосоми на її гомолог ризик народження хворої дитини становить 100%, незалежно від того, хто з батьків є носієм транслокації.
Для визначення ризику повторного народження дитини із патологією важливо встановити гетерозиготних носіїв мутантного гена. Особливе значення це має при аутосомно-рецесивному типі спадкування, при спадкуванні, зчепленому зі статтю, та близьких родинних шлюбах.
У ряді випадків гетерозиготне носійство встановлюється при аналізі родоводу, а також шляхом клінічних та біохімічних аналізів. Так, якщо у батька є рецесивне захворювання, зчеплене з Х-хромосомою (наприклад, гемофілія), то з ймовірністю 100% його дочка буде гетерозиготна за цим геном. Поряд з цим зниження антигемофільного глобуліну в сироватці крові у дочок батька-гемофіліка може бути цілком переконливим доказом гетерозиготного носійства гена гемофілії.
Нині деякі спадкові захворювання встановлюються з допомогою ДНК-діагностики.
Гетерозиготним носіям дефектних генів слід уникати близьких родинних шлюбів, що помітно збільшують ризик народження дітей зі спадковою патологією.
Висновок медико-генетичного консультування та поради батькам (два останні етапи) можуть бути об'єднані. В результаті проведених генетичних досліджень лікар-генетик дає висновок про наявну хворобу, знайомить з ймовірністю виникнення хвороби в майбутньому, дає відповідні рекомендації. При цьому враховується не тільки величина ризику появи хворої дитини, а й тяжкість спадкового або вродженого захворювання, можливості пренатальної діагностики та ефективності лікування. Разом з тим, усі рішення щодо подальшого планування сім'ї приймаються лише подружжям.
Більшість амінокислот в організмі пов'язана в білках, значно менша може виконувати функцію нейромедіаторів (гліцин, у-аміномасляна кислота), служити попередниками гормонів (фенілаланін, тирозин, триптофан, гліцин), коферментів, пігментів, пуринів і піримідинів.
Сучасні уявленняпро вроджені хвороби метаболізму ґрунтуються на результатах вивчення порушень обміну амінокислот. В даний час відомо більше 70 уроджених аміноацидопатій.
Кожне з цих порушень трапляється рідко. Їх частота коливається від 1:10000 (фенілкетонурія) до 1:200000 (алкаптонурія). При одних дефектах визначається надлишок амінокислоти-попередника, за інших накопичуються продукти її розпаду. Характер порушення залежить від місця ферментативного блоку, оборотності реакцій, що протікають вище ушкодженої ланки, та існування альтернативних шляхів витоку метаболітів.
Аміноацидопатіям властива біохімічна та генетична гетерогенність: розрізняють 4 форми гіперфенілаланінемії, 3 варіанти гомоцистинурії, 5 типів метилмалонової ацидемії. Клінічні прояви багатьох аміноацидопатій можна запобігти або послабити при ранній діагностиці та своєчасному початку адекватного лікування: обмеження білка та амінокислот у дієті, добавка вітамінів. Ось чому серед новонароджених проводиться скринінг на аміноацидопатій з використанням різноманітних хімічних та мікробіологічних методіваналізу крові чи сечі. Крім того, для діагностики вроджених порушень обміну амінокислот використовують:
Прямий ферментний метод, використовуючи екстракти лейкоцитів, еритроцитів, культуру фібробластів;
ДНК-ДНК-блотгібридизацію з використанням культури клітин амніотичної рідини.
До найбільш поширених аміноацидопатій належить фенілкетонурія
- один з різновидів гіперфенілаланінемії, обумовленої порушенням перетворення фенілаланіну на тирозин внаслідок зниження активності фенілаланінгідрокси-лази. Дефект успадковується аутосомно-рецесивно, поширений серед європеоїдів і жителів Сходу. У помітних кількостях фенілаланінгідроксилаза виявлена тільки в печінці та вночі. Прямим наслідком порушення гідроксилювання фенілаланіну є накопичення його в крові та сечі та зниження утворення тирозину.
Концентрація фенілаланіну в плазмі досягає рівня, достатньо високого (понад 200 мг/л) для активації альтернативних шляхів обміну з утворенням фенілпірувату, фе. нілацетату, феніллактату та інших похідних, які піддаються нирковому кліренсу та виводяться із сечею. Надлишок фенілу ланіну в рідких середовищах організму гальмує всмоктування в шлунково-кишковому тракті інших амінокислот, а це позбавляє головний мозок інших амінокислот, необхідних для синтезу білка, супроводжується порушенням утворення або стабілізації полірибосом, зниженням синтезу мієліну і недостатнім синтезом.
Фенілаланін -конкурентний інгібітор тирозинази, що є ключовим ферментом на шляху синтезу меланіну. Блокада цього шляху поряд із зменшенням доступності попередника меланіну (тирозину) зумовлює недостатню пігментацію волосся та шкіри.
У новонароджених жодних відхилень від норми не відзначають, проте діти, залишені без лікування з класичною фенілкетонурією, відстають у розвитку; вони прогресують порушення функцій мозку. Гіперактивність та судоми, прогресуюча дисфункція головного мозку та базальних гангліїв зумовлюють різке відставання у психічному розвитку, хорею, гіпотензію, регідність м'язів. Внаслідок накопичення фенілаланіну є «мишачий» запах шкіри, волосся та сечі, схильність до гіпопігментації та екземи. Незважаючи на ранній діагноз та стандартне лікування діти гинуть у перші кілька років життя від вторинної інфекції.
У новонародженого вміст фенілаланіну в плазмі може бути в межах норми при всіх 4 типах гіперфеїїлаланінемії, але після початку годування білком рівень фенілаланіну в крові швидко збільшується і вже зазвичай на 4-й день перевищує норму.
Класичну фенілкетонурію можна діагностувати пренатально за поліморфізмом довжини рестрикційних фрагментів, що ідентифікується за допомогою ДНК-ДНК-блотгібридизації, і після народження дитини за визначенням концентрації фенілаланіну в крові за методом Гутрі (інгібування росту бактерій).
Різке порушення катаболізму тирозину внаслідок недостатності ферменту оксидази гомогентизинової кислотизумовлює розвиток алкаптонурії(алкаптон - пофарбований полімер продуктів окислення гомогентизинової кислоти). Дефект го ферменту викликає підвищену екскрецію гомогентизинової кислоти із сечею та накопичення окисленої гомогентизинової лоти у сполучній тканині (охроноз). Згодом охроноз зумовлює розвиток дегенеративного артриту.
Гомогентизиновая кислота - це проміжний продукт перетворення тирозину на фумарат та ацетоацетат. При зниженні активності оксидази гомогентизинової кислоти в печінці та нирках порушується розкриття фенольного кільця тирозину з утворенням малеїлацетоуксусої кислоти. Внаслідок цього у рідких середовищах та клітинах організму накопичується гомогентизинова кислота. Ця кислота і особливо її окислені полімери зв'язуються колагеном, що призводить до посилення накопичення сірого або синьо-чорного пігменту (охроноз) з розвитком дистрофічних змін у хрящах, міжхребцевих дисках та інших сполучнотканинних утвореннях.
Захворювання успадковується аутосомно-рецесивно.
Алкаптонурія може залишатися нерозпізнаною до розвитку дистрофічних ушкоджень суглобів. Такі симптоми, як здатність сечі хворих темніти при стоянні та легка зміна забарвлення склер та вушних раковин, довгий часможуть виявлятися непоміченими, хоча це ранні зовнішні ознаки захворювання. Потім з'являються вогнища сіро-коричневої пігментації склер і потемніння, що генералізується, вушних раковин, протизавитка і завитка. Вушні хрящі фрагментуються та потовщуються. З'являється охронозний артрит з больовими симптомами та тугорухливістю, особливо в тазостегнових, колінних та плечових суглобах.
Амінокислота тирозин, що надходить з білками їжі і утворюється з фенілаланіну, може перетворюватися:
1) у фенілпіруват після переамінування з а-кетоглютаратом, окислення якого призводить до утворення гомогентизинової кислоти; остання, окислюючись, перетворюється на фумарову, потім ацетооцтову кислоту, що включається в цикл Кребса;
2) ДОФА (n-діоксифенілаланін) за участю тирозиназив норадреналін та меланін;
3) у тетра- та грийодтиронін після йодування;
4) піддаватися декарбоксилювання.
Порушення різних стадійокисного перетворення тирозину за участю тирозинази і, отже, утворення з нього меланіну обумовлює розвиток альбінізму. Затримка окислення тирозину на стадії оксифенілпіровиноградної кислоти (при нестачі вітаміну С та ураженні паренхіми печінки) індукує тирозиноз, який проявляється у підвищеній екскреції із сечею оксифенілпірувату. Межучний обмін триптофану характеризується тим, що він порівняно мало залучається до реакції переамінування та дезамінування. Більшість триптофану перетворюється на нікотинову кислоту(вітамін РР), і цьому етапі утворюється ряд проміжних продуктів: кинуренин, ксантуренова кислота, оксиант-раниловая кислота та інші. Підвищення їхньої концентрації в крові має загальну токсичну дію; Ксантуренова кислота порушує утворення інсуліну. Патологія обміну триптофану може бути пов'язана з недостатністю специфічних ферментів, коферментів та вітаміну В6, що беруть участь у його обміні, а також при осередкових та дифузних ураженнях печінки, при інфекційних захворюваннях, при лікуванні протитуберкульозними препаратами.
Своєрідним порушенням обміну амінокислот є аміноацидурія
-
підвищене їх виділення із сечею. Причини аміноацидурії: порушення дезамінування амінокислот при ураженні печінки та порушення реабсорбції амінокислот у ниркових канальцях при ураженні нирок.
При гострій дистрофії печінки або термінальної стадіїВтрата цирозу з сечею амінокислот дуже значна. Аміноацидурія виникає і при інших патологічних процесах (кахексія, великі травми, м'язова атрофія, гіпертиреоз), протягом яких характеризується посиленим розпадом тканинних білків та збільшенням вмісту амінокислот у крові.
Іноді в сечі відзначається збільшений вміст цистину. цистинурія
як вроджена аномалія обміну, для якої характерне утворення цистинових каменів у сечовивідних шляхах. Більш тяжке порушення обміну цистину - цистиноз,
який супроводжується загальною аміноацидурією, відкладенням кристалів цистину в тканинах і характеризується раннім летальним кінцем.
У цілому нині, основу порушення проміжного обміну амінокислот лежить патологія ферментативних систем (вроджені аномалії синтезу ферментів, загальна білкова недостатність, дистрофічні процеси) чи недостатність тих чи інших вітамінів, гіпоксія, зсув рН та інших.
Патофізіологічне значення порушень проміжної ланки білкового обміну у тому, що з цих порушеннях з'являються токсичні продукти обміну і порушуються кількісні співвідношення між амінокислотами, що у кінцевому підсумку створює умови порушення процесів синтезу білка, освіти та екскреції кінцевих продуктів білкового обміну.
Загальне уявлення про порушення білкового обміну можна отримати щодо азотистого рівноваги організму та навколишнього середовища.
Порушення азотистої рівноваги
Порушення азотистого рівноваги проявляється як позитивного чи негативного азотистого балансу.
Позитивний азотистий баланс
- такий стан, коли з організму виводиться менше азоту, ніж надходить із їжею. Спостерігається воно під час зростання організму, при вагітності, а також після голодування, при надмірній секреції анаболічних гормонів (соматотропний гормон, андрогени та ін.) та при призначенні їх із лікувальною метою.
Анаболічна дія гормонів полягає у посиленні процесів синтезу білка порівняно з його розпадом. Таку дію мають такі "гормони.
Соматотропний гормон
посилює окислення жиру та мобілізацію нейтрального жиру і веде, таким чином, до достатнього звільнення енергії, необхідної для процесів синтезу білка.
Статеві гормони
посилюють процеси синтезу білка.
Інсулін
полегшує перехід амінокислот через клітинні мембранивсередину клітин і таким чином сприяє синтезу білка і послаблює глюконеогенез. Нестача інсуліну веде до зниження синтезу білка та збільшення глюконеогенезу.
Негативний баланс азоту
- стан, коли з організму виводиться більше азоту, ніж надходить із їжею. Негативний азотистий баланс розвивається при голодуванні, протеїнурії, інфекційних захворюваннях, травмах, термічних опіках, хірургічних операціяхпри надмірній секреції або призначенні катаболічних гормонів (кортизол, тироксин та ін).
Катаболічна дія гормонів полягає у посиленні процесів розпаду білків у порівнянні з процесами синтезу. Таку дію мають наступні гормони.
Тироксин
збільшує кількість активних сульфгідрильних груп у структурі деяких ферментів – активуються тканинні катепсини та посилюється їх протеолітична дія. Тироксин підвищує активність амінооксидаз – збільшується дезамінування деяких амінокислот. При гіпертиреозі у хворих розвивається негативний азотистий баланс та креатинурія.
При дефіциті гормонів щитовидної залози, наприклад при гіпотиреозі, недостатність катаболічної дії гормону проявляється у вигляді позитивного балансу азотистого і накопичення креатину.
Глюкокортикоїдні гормони
(Кортизол та ін) посилюють розпад білків. Витрата білків збільшується на потреби глюконеогенезу; у своїй також уповільнюється синтез білка.
Обмін білків може бути порушено на різних етапахперетворень прийнятих із їжею білкових речовин. Можна виділити такі порушення:
- 1) при надходженні, перетравленні та всмоктуванні білків у шлунково-кишковому тракті;
- 2) при синтезі та розпаді білків у клітинах та тканинах організму;
- 3) при проміжному обміні амінокислот;
- 4) на кінцевих етапах білкового обміну;
- 5) у білковому складі плазми крові.
Порушення надходження, перетравлення та всмоктування білків у шлунково-кишковому тракті
Розлади секреції окремих протеолітичних ферментів
шлункового тракту, зазвичай, не викликають серйозних порушень білкового обміну. Так, повне припинення секреції пепсину з шлунковим сокомне відбивається на ступені розщеплення білків у кишечнику, але суттєво впливає швидкість його розщеплення і появи окремих вільних амінокислот.
Відщеплення окремих амінокислот у шлунково-кишковому тракті відбувається нерівномірно. Так, тирозин і триптофан у нормі відщеплюються від білків вже у шлунку, інші амінокислоти - лише під впливом протеолітичних ферментів кишкового соку. Склад амінокислот у вмісті кишечника на початку та в кінці кишкового перетравлення різний.
Амінокислоти можуть надходити в систему ворітної вениу різному співвідношенні. Відносний дефіцит навіть однієї незамінної амінокислоти ускладнює весь процес біосинтезу білків і створює відносний надлишок інших амінокислот із накопиченням в організмі проміжних продуктів обміну цих амінокислот.
Подібні порушення обміну, пов'язані із запізненням відщеплення тирозину та триптофану, виникають при ахілії та субтотальній резекції шлунка.
Порушення всмоктування амінокислот може виникнути при патологічних змінах стінки тонкого кишечника, наприклад, при запаленні, набряку.
Порушення синтезу та розпаду білка
Синтез білка відбувається усередині клітин. Характер синтезу залежить від генетичного набору на хромосомах у ядрі клітини. Під впливом генів, специфічних кожному за виду білка у кожному організмі, активуються ферменти, й у ядрі клітини відбувається синтез інформаційної рибонуклеїнової кислоти (і-РНК). і-РНК є дзеркальною копією дезоксирибонуклеїнової кислоти (ДНК), яка знаходиться в ядрі клітини.
Синтез білка відбувається у цитоплазмі клітини на рибосомах. Під впливом і-РНК на рибосомах синтезується матрична РНК (м-РНК), яка є копією і-РНК і містить закодовану інформацію про вид та послідовність розташування амінокислот у молекулі синтезованого білка.
Для включення амінокислот в молекулу білка відповідно до матриці (м-РНК) необхідна їх активація. Функція активації амінокислот виконує фракція РНК, яка називається розчинною, або транспортною (т-РНК). Активація амінокислот супроводжується їх фосфорилуванням. Приєднання амінокислот за допомогою т-РНК до певних угруповань нуклеотидів м-РНК здійснюється при дефосфорилуванні за рахунок енергії гуанінізтрифосфату. Синтезований білок виконує специфічну функцію у клітині або транспортується з клітини та виконує свою функцію як білок крові, антитіло, гормон, фермент.
Регуляція синтезу білка в клітині генетично обумовлена наявністю не тільки структурних генів, які відають послідовністю розташування основ нуклеотидів при синтезі і-РНК, а й додаткових генів регулюючих. У регуляції синтезу білка в клітині беруть участь ще по Крайній мірідва гени - ген-оператор та регулюючий ген.
Регулюючий ген розповідає синтезом репресора, що є ферментом і гальмує зрештою діяльність структурних генів та освіту и-РНК.
Ген-оператор, або оперуючий ген, безпосередньо підпорядковується дії репресора, що викликає одному випадку репресію, а іншому - дерепресію: поява синтезу низки ферментів, синтезують и-РНК. Оперуючий ген становить єдине ціле зі структурними генами, утворюючи так званий оперон.
Репресивна речовина може перебувати у двох станах: активному та неактивному. В активному стані репресор діє оперуючий ген, припиняє його на структурні гени й у остаточному підсумку припиняє синтез и-РНК і синтез білка.
Активатори репресора звуться корепресорів. Ними можуть бути певна концентрація регульованого білка, так і фактори, що утворилися в результаті дії цього білка.
Регуляція синтезу білка здійснюється в такий спосіб. При нестачі білка у клітині припиняється дія репресора на оперон. Збільшується синтез і-РНК та м-РНК. і рибосомах починається синтез білкових молекул. Концентрація білка зростає. Якщо синтезований білок недостатньо швидко метаболізується, то його кількість продовжує наростати. Певна концентрація цього білка, чи чинників, що утворилися під його дією, може бути корепресором синтезу, активуючи репресор. Припиняється вплив оперуючого гена на структурні гени і припиняється зрештою синтез білка. Його концентрація знижується тощо.
При порушенні регуляції синтезу білка можуть виникати патологічні стани, пов'язані з надлишковим синтезом, і з недостатнім синтезом білка.
Синтез білка може бути порушений під дією різних зовнішніх та внутрішніх хвороботворних факторів:
- а) за неповноцінності амінокислотного складу білків;
- б) при патологічних мутаціях генів, пов'язаних як із появою патогенних структурних генів, так і з відсутністю нормальних регулюючих та структурних генів;
- в) під час блокування гуморальними факторамиферментів, що відають процесами репресії та дерепресії синтезу білка у клітинах;
- г) при порушенні співвідношення анаболічних та катаболічних факторів, що регулюють синтез білка.
Відсутність у клітинах навіть однієї незамінної амінокислоти припиняє синтез білка.
Біосинтез білка може порушуватися не тільки за відсутності окремих незамінних амінокислот, а й за порушення співвідношення між кількістю незамінних амінокислот, що надходять в організм. Потреба окремих незамінних амінокислотахпов'язана з їх участю у синтезі гормонів, медіаторів, біологічно активних речовин.
Недостатнє надходження в організм незамінних амінокислот викликає не лише загальні порушення синтезу білка, але й вибірково порушує синтез окремих білків. Недолік незамінної амінокислоти може супроводжуватися характерними нею порушеннями.
Триптофан
. При тривалому виключенні з харчового раціону у щурів розвивається васкуляризація рогівки та катаракту. У дітей обмеження триптофану в їжі супроводжується зниженням концентрації білків плазми.
Лізін
. Відсутність у їжі супроводжується у людей появою нудоти, запаморочення, головного болю та підвищеної чутливості до шуму.
Аргінін
. Відсутність у їжі може призвести до пригнічення сперматогенезу.
Лейцин
. Відносний надлишок його, порівняно з іншими незамінними амінокислотами, у щурів пригнічує зростання через відповідне порушення засвоєння ізолейцину.
Гістідін
. Недолік його супроводжується зниженням концентрації гемоглобіну.
Метіонін
. Виняток його з їжі супроводжується жировим переродженням печінки, зумовленим недоліком лабільних метильних груп для синтезу лецитину.
Валін
. Недолік його веде до затримки зростання, схуднення, розвитку кератозів.
Замінні амінокислоти суттєво впливають на потребу незамінних амінокислот. Наприклад, потреба в метіоніні визначається вмістом цистину в дієті. Чим більше їжі цистину, тим менше витрачається метионина для біологічного синтезу цистину. Якщо в організмі швидкість синтезу замінної амінокислоти стає недостатньою, виникає підвищена потреба в ній.
Деякі замінні амінокислоти стають незамінними, якщо вони не надходять з їжею, тому що організм не справляється зі швидким їх синтезом. Так, недолік цистину веде до гальмування зростання клітин навіть за наявності решти амінокислот у середовищі.
Порушення регуляції синтезу білка – антитіл
- може спостерігатися при деяких алергічні захворювання. Так, в імунокомпетентних клітинах (клітини лімфоїдного ряду), що продукують антитіла, зазвичай репресовано вироблення аутоантитіл. У процесі ембріонального розвитку при зміні фаз (стадія нервової трубки, листків мезенхіми) відбувається дерепресія синтезу аутоантитіл. У тканинах визначаються аутоантитіла, які беруть участь у розсмоктуванні тканин колишніх фаз розвитку ембріона. Така зміна активності репресорів відбувається кілька разів. У дорослому організмі синтез аутоантитіл репресований. Так, наприклад, репресовано синтез аутоантитіл до антигенів власних еритроцитів. Якщо залежно від групи крові в еритроцитах знаходиться аглютиніноген А, то в плазмі крові відсутні α-аглютиніни, вироблення яких надійно репресовано. На цій основі можлива трансплантація крові та кровотворної тканини(Кісткового мозку).
До деяких тканин (кришталик ока, нервова тканина, тестикули) вироблення аутоантитіл не репресовано, але ці тканини в силу своїх анатомічних і функціональних особливостейізольовані від імунокомпетентних клітин та в нормі вироблення аутоантитіл не відбувається. При порушенні анатомічної ізоляції (ушкодження) починається вироблення аутоантитіл і виникають аутоалергічні захворювання.
Порушення обміну амінокислот
Порушення дезамінування. Окисне дезамінування здійснюється в результаті послідовних перетворень амінокислот в реакціях переамінування та дезамінування:
Амінокислоти за участю специфічних трансаміназ спочатку переамінуються з α-кетоглютарової кислоти. Утворюється кетокислота та глютамат. Глютамат під дією дегідрогенази піддається окислювальному дезамінуванню зі звільненням аміаку та утворенням α-кетоглютарату. Реакції оборотні. Таким чином, утворюються нові амінокислоти. Включення а-кетоглютарової кислоти в цикл Кребса забезпечує включення амінокислот до енергетичного обміну. Окисне дезамінування визначає і утворення кінцевих продуктів білкового обміну.
З переамінування пов'язане утворення аміносахарів, порфіринів, креатину та дезамінування амінокислот. Порушення переамінування виникає при нестачі вітаміну В6, оскільки його форма – фосфопіридоксаль – є активною групою трансаміназ.
Співвідношення субстратів переамінування визначає напрямок реакції. При порушенні сечовиноутворення відбувається прискорення переамінування.
Ослаблення дезамінування виникає при зниженні активності ферментів - амінооксидаз та при порушенні окисних процесів (гіпоксія, гіповітаміноз С, РР, В 2).
При порушенні дезамінування амінокислот збільшується виділення амінокислот із сечею (аміноацидурія), зменшується сечовиноутворення.
Порушення декарбоксилювання. Декарбоксилювання амінокислот супроводжується виділенням СО 2 та утворенням біогенних амінів:

У тваринному організмі декарбоксилювання піддаються лише деякі амінокислоти з утворенням біогенних амінів: гістидин (гістамін), тирозин (тирамін), 5-гідрокситриптофан (серотонін), глютамінова кислота (γ-аміномасляна кислота) і продукти подальших перетворень діоксифенілаланін (ДОФА, оксітірамін) і цистеїнова кислота (таурин) (рис. 47).
Біогенні аміни виявляють свою дію вже за малих концентрацій. Нагромадження амінів у великих концентраціях становить серйозну небезпеку організму. В нормальних умовах аміни швидко усуваються під дією аміноксидази, яка окислює їх у альдегіди:

За цієї реакції утворюється вільний аміак. Інактивація амінів досягається також шляхом їхнього зв'язування з білками.
Нагромадження біогенних амінів у тканинах та крові та прояв їх токсичної дії виникає; при посиленні активності декарбоксилаз, гальмуванні активності оксидаз та порушенні зв'язування їх з білками.
При патологічних процесах, що супроводжуються пригніченням окисного дезамінування, перетворення амінокислот в більшою міроювідбувається шляхом декарбоксилювання із накопиченням біогенних амінів.
Порушення обміну окремих амінокислот. Існує низка спадкових захворювань людини, пов'язаних із вродженими дефектами обміну окремих амінокислот. Ці порушення обміну амінокислот пов'язані з генетично обумовленим порушенням синтезу білкових груп ферментів, які здійснюють перетворення амінокислот (табл. 24).

Порушення обміну фенілаланіну (фенілкетонурія)
. Причиною захворювання є недолік ферменту - фенілаланінгідроксилази в печінці, внаслідок чого блоковано перетворення фенілаланіну на тирозин (рис. 48). Концентрація фенілаланіну в крові досягає 20-60 мг% (у нормі близько 1,5 мг%). Продукти його, метаболізму, зокрема кетокислота - фенілпіруват, токсично впливають на нервову систему. Нервові клітини кори головного мозку руйнуються та заміщаються розростанням мікрогліальних елементів. Розвивається фенілпіровиноградна олігофренія. Фенілпіруват з'являється в сечі і дає зелене забарвлення із трихлорним залізом. Ця реакція проводиться у новонароджених і служить для ранньої діагностикифенілкетонурії.

При розвитку захворювання вже у 6-місячному віці у дитини відзначаються ознаки недостатнього розумового розвитку, просвітлення кольору шкіри та волосся, загальне збудження, посилення рефлексів, підвищення тонусу м'язів та основного обміну, епілепсія, мікроцефалія та ін.
Просвітлення кольору шкіри та волосся розвивається через недостатнє вироблення меланіну, оскільки в результаті накопичення фенілаланіну блокується метаболізм тирозину.
Розвивається недостатність синтезу катехоламінів, знижується рівень інших вільних амінокислот у плазмі. Збільшується виділення кетонових тіл із сечею.
Виняток фенілаланіну з дієти веде до зниження вмісту фенілаланіну та його похідних у крові та перешкоджає розвитку феніл-кетонурії.
Порушення обміну гомогентизинової кислоти
(продукту метаболізму тирозину) – алкаптонурія – виникає при нестачі ферменту – оксидази гомогентизинової кислоти (рис. 49).

При цьому гомогентизинова кислота не переходить у малеїлацетооцтову кислоту (не відбувається розриву гідрохінонового кільця). У нормальних умовах гомогентизиновая кислота у крові визначається. При недостатності ферменту гомогентизиновая кислота у крові і виводиться з організму із сечею. Відзначається характерне потемніння сечі, особливо у лужному середовищі.
Відкладення похідних гомогентизинової кислоти у тканинах викликає пігментацію сполучної тканини – охроноз. Пігмент відкладається в суглобових хрящах, в хрящах носа, вушних раковинах, в ендокарді, великих кровоносних судинах, нирках, легенях, епідермісі. Алкаптонурія часто супроводжує нирковокам'яна хвороба.
Порушення обміну тирозину – альбінізм
. Причиною захворювання є нестача ферменту тирозинази в меланоцитах - клітинах, які синтезують пігмент меланін (рис. 50).

За відсутності меланіну шкіра набуває молочно-білого кольору білим оволосінням (альбінізм), спостерігаються світлобоязнь, ністагм, просвічування райдужної оболонки, зниження гостроти зору. Сонячне опромінення викликає запальні зміни шкіри – еритему.
Альбінізм може супроводжуватися глухотою, немотою, епілепсією, полідактилією та олігофренією. Інтелект таких хворих найчастіше нормальний.
Порушення обміну гістидину
. Мастоцитоз - спадкова хвороба, що супроводжується посиленою проліферацією опасистих клітин. Причиною захворювання вважають підвищення активності гістидиндекарбоксилази - ферменту, що каталізує синтез гістаміну. Гістамін накопичується у печінці, селезінці та інших органах. Хвороба характеризується ураженнями шкіри, порушеннями серцевої діяльності та функції шлунково-кишкового тракту. Відзначається підвищена екскреція із сечею гістаміну.
Гіперамінацидурії
. Виникають при порушенні реабсорбції амінокислот у ниркових канальцях (ниркова гіпераміноацидурія, наприклад цистиноз, цистинурія) або зі збільшенням концентрації амінокислот у крові (позаниркова гіпераміноацидурія, наприклад фенілкетонурія, цистатіонурія).
Цістіноз
. Спостерігається при вродженому дефекті реабсорбції у канальцях нирок цистину, цистеїну та інших нециклічних амінокислот. Екскреція амінокислот із сечею може збільшуватись при цьому в 10 разів. Екскреція цистину та цистеїну зростає у 20-30 разів. Цистін відкладається у нирках, селезінці, шкірі, печінці. Цистиноз супроводжується глюкозурією, гіперкаліурією, протеїнурією та поліурією.
При цистинурії екскреція цистину може збільшуватися до 50 разів у порівнянні з нормою, супроводжуючись пригніченням реабсорбції лізину, аргініну та орнітину в ниркових канальцях. Рівень цистину у крові вбирається у норми. Не виявлено порушень у проміжному обміні цих амінокислот. Підвищена екскреція амінокислот може призвести до порушень синтезу білка та білкової недостатності.
Порушення кінцевих етапів білкового обміну
Порушення сечовиноутворення. Кінцевими продуктами розпаду амінокислот є аміак, сечовина, СО 2 та Н 2 О. Аміак утворюється у всіх тканинах внаслідок дезамінування амінокислот. Аміак токсичний, при накопиченні його ушкоджується протоплазма клітин. Для зв'язування аміаку та його знешкодження існують два механізми: у печінці утворюється сечовина, а в інших тканинах аміак приєднується до глютамінової кислоти (амідування) – утворюється глютамін. Надалі глютамін віддає аміак для синтезу нових амінокислот, перетворення яких завершуються утворенням сечовини, що виділяється із сечею. З усього азоту сечі частку сечовини припадає 90% (аміаку близько 6%).
Синтез сечовини відбувається в печінці в цитрулінаргінінорнітиновому циклі (рис. 51). Існують захворювання, пов'язані зі спадковим дефектом ферментів сечовиноутворення.

Аргінінсукцинатурія
. Полягає в гіпераміноацидурії (аргінінобурштинова кислота) та в олігофренії. Причина – дефект ферменту аргініносукцинатліази.
Амонійемія
. У крові збільшено концентрацію аміаку. Підвищена екскреція глютаміну із сечею. Причина захворювання – блокування карбамілфосфатсинтетази та орнітинкарбамоїлтрансферази, що каталізують зв'язування аміаку та утворення орнітину в циклі сечовиноутворення.
Цитрулінурія
. Концентрація цитруліну в крові може збільшуватися понад 50 разів. З сечею екскретується до 15 г цитруліну на добу. Причина – спадковий дефект аргінінсукцинат-синтетази.
Активність ферментів синтезу сечовини порушується і при захворюваннях печінки (гепатити, застійний цироз), гіпопротеїнеміях, пригніченні окисного фосфорилювання. У крові та тканинах накопичується аміак – розвивається амонійна інтоксикація.
Найбільш чутливі до надлишку аміаку клітини нервової системи. Крім безпосередньої ушкоджуючої дії аміаку на нервові клітиниаміак зв'язується глютаматом, в результаті чого він вимикається з обміну. При прискоренні переамінування амінокислот з α-кето-глютарової кислотою, вона не включається до циклу Кребса, обмежується окислення піровиноградної та оцтової кислот і вони перетворюються на кетонові тіла. Знижується споживання кисню. Розвивається коматозний стан.
Порушення обміну сечової кислоти. Подагра. Сечова кислота - кінцевий продукт обміну амінопуринів (аденін та гуанін) у людини. У рептилій та птахів сечова кислота є кінцевим продуктом обміну всіх азотистих сполук. У крові у людини зазвичай міститься 4 мг% сечової кислоти. При надмірному споживанні продуктів, багатих на пуринові нуклеотиди та амінокислоти, з яких в організмі синтезуються пуринові основи (печінка, нирки), в організмі збільшується кількість сечової кислоти. Концентрація її зростає також за нефритів, лейкемій. Виникає гіперурекемія.
Іноді гіперурекемія супроводжується відкладенням солей сечової кислоти в хрящах, сухожильних піхвах, нічках, шкірі та м'язах, оскільки сечова кислота погано розчинна. Навколо відкладів кристалічних уратів виникає запалення - створюється грануляційний вал, що оточує омертвілі тканини, утворюються подагричні вузли. Урекемія може супроводжуватися випаданням солей сечової кислоти у сечових шляхах з утворенням конкрементів.
Патогенез подагри не зрозумілий. Припускають, що захворювання має спадковий характер і пов'язане з порушенням факторів, що підтримують сечову кислоту в розчинному стані. Ці фактори пов'язані з обміном мукополісахаридів та мукопротеїдів, які утворюють центр кристалізації. При порушенні функції печінки (інтоксикація) збільшується відкладення уратів у тканинах та виділення уратів із сечею.
Порушення білкового складу крові
Гіпопротеїнемія- Зменшення загальної кількостібілка у крові, що виникає головним чином за рахунок зменшення альбумінів.
У механізмі виникнення гіпопротеїнемії основними патогенетичними факторами є набуті ними спадково зумовлені порушення синтезу білків крові, вихід сироваткових білків із кровоносного русла без подальшого повернення до судин та розрідження крові.
Порушення синтезу білків крові
залежать від ослаблення синтетичних процесів в організмі (голодування, порушення засвоєння харчових білків, авітамінози, виснаження організму внаслідок тривалої інфекційної інтоксикації або злоякісних новоутворень та ін.).
Синтез білків крові може знижуватися і при порушенні функції органів та тканин, які продукують ці білки. При захворюваннях печінки (гепатити, цироз) знижується вміст у плазмі крові альбуміну, фібриногену, протромбіну. Трапляються спадкові дефекти синтезу тих чи інших білкових фракцій крові, наприклад спадкові форми: афібриногенемія та агаммаглобулінемія. Виражена недостатність синтезу гамма-глобуліну пов'язана з повною відсутністюу таких хворих плазматичних клітин у всіх тканинах та значним зменшенням кількості лімфоцитів у лімфатичних вузлах.
Вихід білків із кровоносного русла
спостерігається при:
- а) крововтратах, пораненнях, великих крововиливах;
- б) плазмо-втратах, зокрема опіках;
- в) підвищенні проникності стінки капілярів, наприклад при запаленні та венозному застої.
При великих запальних процесах падає в крові вміст альбумінів внаслідок їхнього виходу з судин в інтерстиціальний простір (рис. 52). Велика кількість альбумінів виявляється також в асцитичній рідині при портальній гіпертонії та серцевій недостатності.

Гіпоальбумінемія може виникати при порушенні реабсорбції білка в нирках, наприклад при нефрозах.
При гіпопротеїнемії внаслідок зменшення вмісту альбумінів падає онкотичний тиск крові, що призводить до набряків.
При абсолютному зниженні кількості альбумінів у крові порушується зв'язування та транспорт катіонів (кальцію, магнію), гормонів (тироксину), білірубіну та інших речовин, що супроводжується низкою функціональних розладів.
При дефіциті гаптоглобіну, білка з фракції α 2 -глобулінів, порушується зв'язування та транспорт гемоглобіну, що звільняється при фізіологічному гемолізі еритроцитів, і гемоглобін втрачається із сечею.
Падіння синтезу антигемофільного глобуліну з фракції β 2 -глобулінів призводить до кровоточивості.
При нестачі трансферину, що відноситься до β 1 -глобулінів, порушується перенесення заліза.
Основним наслідком гіпо-або агаммаглобулінемії є зниження імунітету через порушення вироблення антитіл (γ-глобулінів). У той же час відсутня реакція на гомологічні трансплантати (не утворюються антитіла до чужорідної тканини та можливе її приживлення).
Гіперпротеїнемія. Найчастіше розвивається відносна гіперпротеїнемія з підвищенням концентрації білків у крові, хоча абсолютна їх кількість не збільшується. Такий стан виникає при згущенні крові через втрату організмом води.
Абсолютна гіперпротеїнемія, як правило, пов'язана з гіперглобулінемією. Наприклад, збільшення вмісту γ-глобулінів характерне для інфекційних захворюваньколи відбувається інтенсивна продукція антитіл. Гіпергаммаглобулінемія може виникати як компенсаторна реакція на нестачу в крові альбумінів. Наприклад, при хронічні захворюванняпечінки (цироз) порушується синтез альбумінів; кількість білків у крові не зменшується, а зростає за рахунок інтенсивного синтезу γ-глобулінів. При цьому можуть утворюватися неспецифічні γ-глобуліни.
Переважна більшість глобулінів над альбумінами змінює альбуміново-глобуліновий коефіцієнт крові у бік його зменшення (у нормі дорівнює 2-2,5).
При деяких патологічних процесах та захворюваннях змінюється в крові відсоткове співвідношенняокремих білкових фракцій, хоча загальний вміст білка суттєво не змінюється. Наприклад, при запаленні збільшується концентрація захисного білка пропердину (від лат. perdere – руйнувати). Пропердин у поєднанні з комплементом має бактерицидні властивості. У його присутності піддаються лізису бактерії та деякі віруси. Зміст пропердину в крові зменшується при іонізуючій радіації.
Парапротеїнемія
. Значна гіперпротеїнемія (до 12-15% і більше білка в крові) відзначається з появою великої кількостіаномальних глобулінів. Типовим прикладом зміни синтезу глобулінів є мієлома (плазмоцитома). Мієлома – різновид лейкозів (парапротеїнемічний ретикулоз).
При γ-мієломі ненормальні глобуліни синтезуються пухлинними клонами плазматичних клітин, які надходять у периферичну кров, становлячи 60% і більше загальної кількості лейкоцитів. Патологічний мієломний білок не має властивості антитіл. Він має малу молекулярну вагу, проходить через нирковий фільтр, відкладається у нирках, сприяючи у 80% випадків розвитку ниркової недостатності. При мієломі різко прискорюється РВЕ (60-80 мм на годину) внаслідок переважання глобулінів над альбумінами.
Існує захворювання макроглобулінемія Вальденстрема, що характеризується пухлиноподібним розростанням клітин лімфоїдного ряду та підвищеною продукцією макроглобулінів з молекулярною вагою понад 1 000 000. Макроглобуліни наближаються до глобулінів групи М (JqM); у нормі їх є трохи більше 0,12%. При описуваному захворюванні їх вміст сягає 80% від загальної кількості білка в плазмі, в'язкість крові збільшується в 10-12 разів, що ускладнює роботу серця.
Порушення обміну при різних захворюваннях може супроводжуватися появою в крові абсолютно нових білків. Наприклад, у гострій фазі ревматизму, при стрептококовій, пневмококової інфекції, інфаркті міокарда у сироватці крові знайдено С-реактивний білок(С-реактивним він названий тому, що дає реакцію преципітації з С-полісахаридом пневмококів). С-реактивний білок при електрофорез переміщається між α- і β-глобулінами; до антитіл не належить. Очевидно, його поява відбиває реакцію ретикулоэндотелиальной системи на продукти розпаду тканин.
До незвичайного білка крові відноситься також кріоглобулін, який в електричному полі пересувається з γ-глобулінами. Кріоглобулін здатний випадати в осад за температури нижче 37°. Він з'являється при мієломі, нефрозі, цирозі печінки, лейкоцитах та інших захворюваннях. Наявність кріоглобуліну в крові хворих небезпечна, тому що при сильному місцевому охолодженні білок випадає в осад, що сприяє утворенню тромбів та некрозу тканин.
Леон Е. Розенберг (Leon E. Rosenberg)
Ряд вроджених порушень обміну речовин характеризується відкладенням чи накопиченням у тканинах надлишкової кількості окремих метаболітів. Найчастіше це відбиває порушення процесів розпаду речовини, але у деяких випадках механізм захворювання залишається невідомим. При багатьох захворюваннях накопичуються великі молекули, такі як глікоген, сфінголіпіди, муколіпіди, ефіри холестерину та мукополісахариди (див. гл. 313, 315 та 316), при інших-метали, наприклад залізо та мідь (див. гл. 310 та 311). Нарешті, існує група хвороб, у яких накопичуються порівняно невеликі органічні молекули. До цієї групи відноситься подагра (див. гл. 309), а також низку порушень амінокислотного обміну.
Алкаптонурія
Визначення. Алкаптонурія є рідкісним порушенням катаболізму тирозину. Недостатність ферменту оксидази гомогентизинової кислоти призводить до екскреції великих кількостей цієї кислоти із сечею та накопичення пігменту (окислена гомогентизинова кислота) у сполучній тканині (охроноз). Через багато років охроноз зумовлює розвиток особливої форми дегенеративного артриту.
Етіологія та патогенез. Гомогентизиновая кислота - це проміжний продукт перетворення тирозину на фумарат та ацетоацетат. У хворих з алкаптонурією в печінці та нирках знижено активність оксидази гомогентизинової кислоти - ферменту, що каталізує розкриття фенольного кільця з утворенням малеїлацетооцтової кислоти. В результаті в клітинах та рідких середовищах організму накопичується гомогентизинова кислота. Кількість останньої у крові хворих збільшується незначно, оскільки вона дуже швидко виводиться нирками. За добу із сечею може виділятись до 3-7 г гомогентизинової кислоти, що практично не має патофізіологічного значення. Однак гомогентизиновая кислота та її окислені полімери зв'язуються колагеном, що призводить до посилення накопичення сірого або синьо-чорного пігменту. При цьому механізми розвитку дистрофічних змін у хрящах, міжхребцевих дисках та інших сполучнотканинних утвореннях невідомі, але могли б полягати у простому хімічному подразненні сполучної тканини або порушенні її метаболізму.
Алкаптонурія була першим захворюванням людини із встановленим аутосомним рецесивним успадкуванням. Хворі гомозиготи зустрічаються з частотою приблизно 1:200 000. Гетерозиготні носії клінічно здорові та не екскретують гомогентизинову кислоту із сечею навіть після навантаження тирозином.
Клінічні прояви. Алкаптонурія може залишатися нерозпізнаною до зрілого віку, коли в більшості хворих розвивається дистрофічне пошкодження суглобів. До того часу здатність сечі хворих темніти при стоянні, так само як і легка зміна забарвлення склер і вушних раковин, може не привертати до себе уваги. Останні прояви (зміна забарвлення) служать зазвичай ранніми зовнішніми ознаками захворювання і з'являються у віці після 20-30 років. Характерні вогнища сіро-коричневої пігментації склер та генералізоване потемніння вушних раковин, протизавитків і, нарешті, завитків. Вушні хрящі можуть фрагментуватися та товщати. Охронозний артрит проявляється болем, тугорухливістю та деяким обмеженням амплітуди рухів у тазостегнових, колінних та плечових суглобах. З'являються непостійні напади гострого артриту, які можуть нагадувати ревматоїдні, але дрібні суглобизазвичай залишаються інтактними. Часто пізні прояви зводяться до обмеження рухливості та анкілозу попереково-крижового відділу хребта. Приєднується пігментація серцевих клапанів, гортані, барабанної перетинкита шкіри. Іноді у хворих у нирках або передміхуровій залозі утворюються пігментовані камені. У хворих старшого віку найчастіше визначаються дистрофічні зміни серцево-судинної системи.
Діагностика Алкаптонурію слід підозрювати в осіб, сеча яких при стоянні темніє до чорноти, але за умов користування сучасними ватерклозетами цю ознаку вдається спостерігати нечасто. Діагноз ставлять зазвичай на підставі тріади симптомів: дегенеративного артриту, охронозної пігментації та почорніння сечі після її підлужування. Присутність гомогентизинової кислоти в сечі можна припустити і на підставі інших тестів: при додаванні хлористого заліза сеча набуває фіолетово-чорного кольору, реагенту Бенедикта - коричневого забарвлення, а насиченого розчину нітрату срібла - у чорне. Результати цих скринінг-тестів можна підтвердити хроматографічними, ферментативними або спектрофотометричними визначеннями гомогентизинової кислоти. Патогномонічні ознаки виявляються за допомогою рентгенографії поперекового відділу хребта. На рентгенограмах виявляють дегенерацію та щільну кальцинацію міжхребцевих дисків, а також звуження міжхребцевих просторів.
Лікування. Специфічного лікування при охронозному артриті немає. Симптоматику з боку суглобів можна було б послабити, зменшивши накопичення та відкладення гомогентизинової кислоти шляхом обмеження споживання з їжею фенілаланіну та тирозину, але тривалість захворювання не дозволяє робити подібних спроб. Оскільки окисленню та полімеризації гомогентизинової кислоти in vitro перешкоджає аскорбінова кислота, передбачалася можливість її використання як засіб, що знижує утворення та відкладення пігменту. Ефективність цього лікування не встановлена. Симптоматичне лікування подібне до такого при остеоартриті (гл. 274).
Цістіноз
Визначення. Цистиноз – це рідкісне захворювання, що характеризується накопиченням вільного цистину в лізосомах різних тканин організму. Це призводить до появи кристалів цистину в рогівці, кон'юнктиві, кістковому мозку, лімфатичних вузлах, лейкоцитах та внутрішніх органах. Відомі три форми хвороби: інфантильна (нефропатична), що зумовлює розвиток синдрому Фанконі та ниркової недостатності протягом перших 10 років життя, ювенільна (проміжна), при якій ураження нирок проявляється протягом другого 10-річчя життя, та доросла (доброякісна), цистина у рогівці, але не в нирках.
Етіологія та патогенез. Головний дефектпри цистинозі полягає у порушенні «відтоку» цистину з лізосом, а не в порушенні його розпаду. Цей «відтік» є активним АТФ-залежним процесом. При інфантильній формі вміст цистину в тканинах може перевищувати норму більш ніж у 100 разів, а за дорослої форми – більш ніж у 30 разів. Внутрішньоклітинний цистин локалізується в лізосомах і не обмінюється з іншими внутрішньо-і позаклітинними пулами амінокислоти. Концентрація цистину в плазмі та сечі істотно не збільшується.
Ступінь накопичення кристалів цистину у різних хворих варіює залежно від форми захворювання та способів обробки проб тканини. Накопичення цистину в нирках при інфантильній та ювенільній формах хвороби супроводжується нирковою недостатністю. Нирки стають блідими та зморщеними, їхня капсула зливається з паренхімою, зникає межа між кірковим та мозковим шаром. При мікроскопії виявляється порушення цілісності нефрону; клубочки гіалінізовані, прошарок сполучної тканини збільшено, нормальний епітелій канальців заміщений кубоподібними клітинами. Звуження та укорочення проксимальних канальців обумовлює їхню деформацію у вигляді лебединої шиї, що характерно, але не патогномонічно для цистинозу. При інфантильній та ювенільній формах хвороби іноді відзначають осередкову депігментацію та дегенерацію периферичних відділів сітківки очей. Кристали цистину можуть відкладатися також у кон'юнктиві та судинної оболонкиочей.
Будь-яка форма цистинозу успадковується, мабуть, як аутосомна рецесивна ознака. Облігатні гетерозиготи за внутрішньоклітинним вмістом цистину займають проміжне положення між здоровими та хворими, але клінічні симптомиу них немає.
Клінічні прояви. При інфантильній формі хвороби порушення проявляються зазвичай у віці 4-6 місяців. Зростання дитини затримується, у нього з'являються блювання, гарячковий стан, приєднуються резистентний до вітаміну D рахіт, поліурія, дегідратація та метаболічний ацидоз. Генералізована дисфункція проксимальних канальців (синдром Фанконі) призводить до гіперфосфатурії та гіпофосфатемії, ниркової глюкозурії, загальної аміноацидурії, гіпоурикемії та найчастіше до гіпокаліємії. На прогресування клубочкової недостатності можуть впливати пієлонефрит та інтерстиціальний фіброз. Смерть від уремії чи випадкової інфекції настає зазвичай до 10 років. Протягом кількох перших років життя відзначається фотофобія через відкладення цистину в рогівці, ще раніше може виявитися дегенерація сітківки.
На відміну від цього, при дорослій формі хвороби розвивається лише очна патологія. До основних симптомів відносяться фотофобія, головний біль і відчуття печіння або сверблячки в очах. Функція клубочків та канальців нирок, а також цілісність сітківки зберігаються. Ознаки ювенільної форми хвороби займають проміжне положення між цими крайніми формами. У цих хворих у процес залучаються як очі, і нирки, але останні трохи страждають до другого 10-річчя життя. Однак, хоча нирки страждають менше, ніж при інфантильній формі хвороби, хворі вмирають зрештою саме від ниркової недостатності.
Діагностика Цистиноз слід підозрювати у будь-якої дитини з резистентним до вітаміну D рахітом, синдромом Фанконі або клубочковою недостатністю. Гексагональні або прямокутні кристали цистину можна виявити в рогівці (при дослідженні за допомогою щілинної лампи), лейкоцитах периферичної крові або кісткового мозку або біоптатах слизової оболонки прямої кишки. Діагноз підтверджують шляхом кількісного визначення цистину в лейкоцитах периферичної крові чи культурі фібробластів. Інфантильна форма хвороби діагностується пренатально за підвищеним рівнем цистину у культурі клітин амніотичної рідини.
Лікування. Доросла форма протікає доброякісно та не потребує лікування. Симптоматичне лікування при хворобі нирок при інфантильній або ювенільній формі цистинозу не відрізняється від такого при інших видах хронічної ниркової недостатності: забезпечення адекватного споживання рідини, щоб уникнути дегідратації, корекція метаболічного ацидозу та споживання додаткових кількостей кальцію, фосфату та вітаміну D, . Ці заходи можуть протягом певного часу підтримувати зростання, розвиток та гарне самопочуттяхворих дітей Робилися спроби використання двох видів специфічнішого лікування, але вони супроводжувалися великим успіхом. Збіднена цистином дієта не запобігала прогресуванню ниркової патології. Так само застосування сульфгідрильних реагентів (пеніциламін, димеркапрол) і відновників (вітамін С) не супроводжувалося довготривалим ефектом.
Найбільш перспективним видом лікування нефропатичного цистинозу є пересадка нирки. Цей метод був застосований при лікуванні більш ніж 20 дітей з останньою стадієюниркової недостатності. У хворих, які перенесли операцію та уникнули імунологічних проблем, функція нирки нормалізувалася. У трансплантованих нирках не розвивалися типові для цистинозу функціональні порушення (наприклад синдром Фанконі або клубочкова недостатність). Однак у них іноді знову накопичувалося кілька цистину, мабуть, через міграції інтерстиціальних чи мезангиальных клітин організму-господаря.
Первинна гіпероксалурія
Визначення. Первинна гіпероксалурія – це загальна назвадвох рідкісних порушень, що характеризуються хронічною екскрецією із сечею надлишкових кількостей щавлевої кислоти, нирковим камінням з оксалату кальцію та нефрокальцинозом. Як правило, при тій та іншій формі хвороби вже в ранні роки життя розвивається ниркова недостатність та хворі помирають від уремії. При аутопсії як у нирках, так і у позаниркових тканинах виявляють поширені вогнища відкладів оксалату кальцію. Цей стан називають оксалозом.
Етіологія та патогенез. Метаболічна основа первинної гіпероксалурії лежить у порушенні шляхів обміну гліоксилату. При гіпероксалурії І типу підвищена екскреція із сечею оксалату, а також окислених та відновлених форм гліоксилату. Прискорений синтез цих речовин пояснюється блокадою альтернативного шляхуобміну гліоксілат. У печінці, нирках та селезінці знижена активність α-кетоглутаратгліоксилаткарболігази, що каталізує утворення β-гідрокси-β-кетоадипінової кислоти. Зростання гліоксилатного пулу, що виникає в результаті, призводить до посилення як окислення гліоксилату в оксалат, так і відновлення його в гліколат. Обидві ці двовуглецеві кислоти екскретуються із сечею у надмірній кількості. При гіпероксалурії II типу підвищена екскреція із сечею не лише оксалату, а й L-гліцеринової кислоти. При цьому в лейкоцитах (і, ймовірно, в інших клітинах) відсутня активність дегідрогенази D-гліцеринової кислоти - ферменту, що каталізує відновлення гідроксипірувату в D-гліцеринову кислоту в катаболічних реакціях обміну серину. Гідроксипіруват, що накопичується, замість цього відновлюється лактатдегідрогеназою в L-ізомер гліцерату, який і екскретується з сечею. Відновлення гідроксипірувату якимось чином пов'язане з окисленням гліоксилату в оксалат, тобто з утворенням підвищених кількостей останнього. Обидва порушення успадковуються, мабуть, як аутосомні рецесивні ознаки. У гетерозигот клінічна симптоматика відсутня.
Патогенез каменеутворення в нирках, нефрокальциноз і оксалоз безпосередньо пов'язаний з нерозчинністю оксалату кальцію. Поза нирками великі скупчення оксалату виявляються в серці, стінках артерій і вен, сечостатевих шляхаху чоловіків та в кістках.
Клінічні прояви. Нефролітіаз та оксалоз можуть виявлятися вже на першому році життя. У більшості хворих ниркові кольки або гематурія виникають у віці 2-10 років, а уремія розвивається у віці до 20 років. З появою уремії у хворих можуть виникати різкі спазми периферичних артерій та некроз їх стінок, що призводить до судинної недостатності. У міру зниження функції нирок екскреція оксалату зменшується. При пізній появі симптомів хворі можуть досягати віку 50-60 років, незважаючи на рецидивуючий нефролітіаз.
Діагностика У здорових дітей або дорослих осіб добова екскреція оксалату не досягає 60 мг на 1,73 м2 поверхні тіла. У хворих з гіпероксалурією І або ІІ типу цей показник перевищує норму у 2-4 рази. Диференціювати два типи первинної гіпероксалурії можна за результатами визначення інших органічних кислот: для типу I характерна екскреція гліколевої кислоти, а для II - L-гліцеринової кислоти. Необхідно виключити недостатність піридоксину або хронічний процес у клубової кишки, оскільки ці стани також можуть супроводжуватися екскрецією надлишкових кількостей оксалату.
Лікування. Задовільного лікування немає. Рівень оксалату в сечі вдається тимчасово знизити шляхом збільшення швидкості сечовиділення. Він може знижуватись і після введення великих доз піридоксину (100 мг на добу), але його тривалий ефект виражений слабко. Частота нападів ниркової кольки зменшується, мабуть, при дотриманні дієти з високим змістомфосфату, але екскреція оксалату у своїй не змінюється. Не допомагає і пересаджування нирки, оскільки відкладення оксалату кальцію порушує функцію трансплантованого органу.